题目内容
【题目】钴、镍与铁是同族元素,它们的单质及化合物的性质有很多相似之处。
(1)为了比较Fe、Co、Cu三种金属的活动性,某实验小组设计如下甲、乙、丙三个实验装置。丙装置中X、Y均为石墨电极。反应一段时间后,可观察到甲装置中Co电极附近产生气泡,丙装置中X极附近溶液变红。
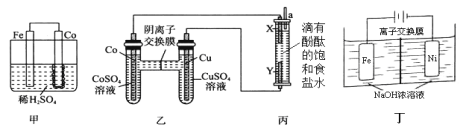
①甲池Fe电极反应式为_________。由现象可知三种金属的活动性由强到弱的顺序是__________(填元素符号)。
②写出丙装置中反应的离子方程式____________________。
(2)Na2FeO4具有广泛用途,可通过电解法制取得到,工作原理图丁所示。通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。已知: Na2FeO4只在强碱性条件下稳定,易被H2还原。
①Fe电极反应式为________。
②电解过程中,须将阴极产生的气体及时排出,其原因是_______________。
③当阴极产生112mL(标准状况)的气体时,通过阴离子交换膜的离子有_______mol。
【答案】Fe-2e-=Fe2+ Fe>Co>Cu 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ Fe - 6e- + 8OH = FeO42 + 4H2O 阴极产生H2,防止Na2FeO4与H2反应使产率降低 0.01
2OH-+H2↑+Cl2↑ Fe - 6e- + 8OH = FeO42 + 4H2O 阴极产生H2,防止Na2FeO4与H2反应使产率降低 0.01
【解析】
⑴①甲装置中Co电极附近产生气泡,说明Co为正极,Fe为负极,其电极反应式为Fe-2e-= Fe2+,金属活动性为Fe>Co,丙装置中X极附近溶液变红,说明X处有大量氢氧根,此处氢离子消耗,X为阴极,Co为负极,Cu为正极,因此三种金属的活动性由强到弱的顺序是Fe>Co>Cu。
②丙装置为电解食盐水,其反应的离子方程式2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑。
2OH-+H2↑+Cl2↑。
⑵①Fe在阳极反应生成高铁酸根,其电极反应式为Fe - 6e-+ 8OH-= FeO42 + 4H2O。
②电解过程中,须将阴极产生的气体及时排出,根据已知信息Na2FeO4易被H2还原。
③当阴极产生112mL(标准状况)的气体即0.005mol氢气。
H2 ~ 2OH -
1mol 2mol
0.005mol xmol
1mol:0.005mol = 2mol:xmol
解得x = 0.01mol,即有0.01mol氢氧根离子生成,要使溶液呈电中性,则需要0.01molOH-通过阴离子交换膜。
⑴①甲装置中Co电极附近产生气泡,说明Co为正极,Fe为负极,其电极反应式为Fe-2e-= Fe2+,金属活动性为Fe>Co,丙装置中X极附近溶液变红,说明X处有大量氢氧根,此处氢离子消耗,X为阴极,Co为负极,Cu为正极,因此三种金属的活动性由强到弱的顺序是Fe>Co>Cu,故答案为:Fe-2e-= Fe2+;Fe>Co>Cu。
②丙装置为电解食盐水,其反应的离子方程式2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑。
2OH-+H2↑+Cl2↑。
⑵①Fe在阳极反应生成高铁酸根,其电极反应式为Fe - 6e-+ 8OH-= FeO42 + 4H2O,故答案为:Fe - 6e-+ 8OH-= FeO42 + 4H2O。
②电解过程中,须将阴极产生的气体及时排出,阴极是水电离的H+放电产生H2,根据已知信息Na2FeO4易被H2还原,故答案为:阴极产生H2,防止Na2FeO4与H2反应使产率降低。
③当阴极产生112mL(标准状况)的气体即0.005mol氢气。
H2 ~ 2OH-
1mol 2mol
0.005mol xmol
1mol:0.005mol = 2mol:xmol
解得x = 0.01mol,即有0.01mol氢氧根离子生成,要使溶液呈电中性,则需要0.01molOH-通过阴离子交换膜,故答案为:0.01。

【题目】25℃时,电离平衡常数如下表,下列说法错误的是
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
A.离子结合质子的能力由大到小的顺序是:CO32- > ClO- > HCO3- > CH3COO-
B.2ClO-+CO2+H2O=CO32-+2HClO反应不能发生
C.用蒸馏水稀释0.10mol·L-1的醋酸,c(CH3COO-)/c(CH3COOH)的数值逐渐增大
D.等体积、等pH的CH3COOH与HClO两溶液与NaOH恰好完全反应,CH3COOH消耗氢氧化钠物质的量更多
【题目】下表各组物质之间通过一步反应不可以实现如下图所示转化关系的是

选项 | X | Y | Z | 箭头上所标数字的反应条件 |
A | SiO2 | Na2SiO3 | H2SiO3 | ①与Na2CO3熔融 |
B | NaCl | NaHCO3 | Na2CO3 | ②加热 |
C | N2 | NO2 | HNO3 | ③加热 |
D | C | CO | CO2 | ④灼热炭粉 |
A. A B. B C. C D. D
【题目】常温下,现有氨水和盐酸两溶液。回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 ________。(增大、减小、不变)
________。(增大、减小、不变)
(2)若向该氨水中加入氢氧化钠固体,则该电离平衡向_________方向移动(分子化、离子化),电离平衡常数______________。(增大、减小或不变)
(3)0.2 mol/L氨水和0.2 mol/L 盐酸溶液与等体积混合,溶液呈_____性 (酸、碱、中) ;其原因用离子方程式表示为__________________。混合液中,c(NH4+)+c(NH3H2O)=_______mol/L。(忽略体积变化)。请根据电荷守恒写出一个用离子浓度表示的等式_____________________。
(4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
序号 | 0.100mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
1 | 27.83 | 25.00 |
2 | 26.53 | 25.00 |
3 | 27.85 | 25.00 |
该滴定可以使用的指示剂是__________;达到滴定终点时的现象是____________________。
待测NaOH溶液的物质的量浓度为_____________mol/L。(保留四位有效数字)


