题目内容
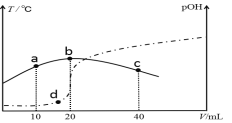
【题目】常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是

A.在任何溶液中,c(Ca2+)、c(SO42-)均相等
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol/L
C.a点对应的Ksp等于c点对应的Ksp
D.d点溶液通过蒸发可以变到c点
【答案】C
【解析】
A.只有在单一CaSO4溶液中c(Ca2+)、c(SO42-)才相等,故A错误;
B.b点Qc>Ksp,故有沉淀生成,开始c(Ca2+)、c(SO42-)不相等而反应消耗的Ca2+、SO42-相等,因此平衡后的两种离子也不会都等于3×10-3mol/L,故B错误;
C.a、c点都在同一平衡线上,在平衡线上的Ksp均相等,故C正确;
D.d点通过蒸发后各离子浓度都增大,不可能保持SO42-浓度不变而到达c点,故D错误;
答案是C。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案【题目】海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含量/mgL-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |
(1)海水显弱碱性的原因是(用离子方程式表示):____________,该海水中Ca2+的物质的量浓度为__________mol/L 。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过,电极均为惰性电极。

① 开始时阳极的电极反应式为________________。
② 电解一段时间,____极(填“阴”或“阳”)会产生水垢,其成份为_____(填化学式)。
③ 淡水的出口为a、b、c中的__________出口。
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图所示:

该电池电解质为能传导 Li+的固体材料。
上面左图中的小黑点表示_____(填粒子符号),充电时该电极反应式为_______。
(4)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下氯气和空气的体积比为_________(空气中氧气的体积分数按20%计)。