题目内容
1.随着世界粮食需求量的增加,农业对化学肥料的需求越来越大.氮肥是需求最大的一种化肥.氮肥的生产和合理施用在农业生产中起着重大作用.合成氨、化肥生产及制取纯碱流程示意图如下: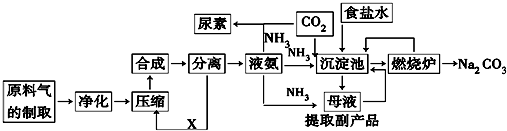
(1)目前,工业上用铁触媒作催化剂,在20~50MPa、450℃左右用氮、氢混合气体在氨合成塔中进行合成氨.则沿X方向回去的物质是N2和H2.
(2)2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,氢气和氮气在电极上合成了氨,反应物转化率大大提高.新法合成氨电解池中的电解质能传导H+,请写出阴极反应式N2+6H++6e-═2NH3.
(3)尿素的结构简式H2NCONH2.目前生产尿素是以氨气与CO2为原料,发生反应的化学方程式是:CO2+2NH3$\frac{\underline{\;一定条件\;}}{\;}$H2NCONH2+2H2O.
(4)氨碱法所用CO2来源于碳酸钙高温分解,联合制碱法CO2来源于合成氨厂.沉淀池中发生反应的化学方程式是NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl.
(5)联合制碱法是对氨碱法的改进,其主要优点是能提高原料的利用率,减少废渣(CaCl2)的排放,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高;NH4Cl 可做氮肥.(回答两点)
分析 (1)氮气和氢气的反应在合成塔中进行,因为合成氨反应为可逆反应,反应后化合物中含有一定量的氮气和氢气,分离后再作为原料进行循环利用;
(2)阴极上N2得电子生成NH3;
(3)尿素的结构简式为H2NCONH2;氨气与CO2反应生成H2NCONH2和2H2O;
(4)联合制碱法中CO2来源于石灰石煅烧,氨碱法中CO2的来源于合成氨工业的废气;在沉淀池中NH3、CO2、H2O、NaCl反应生成NH4Cl 和 NaHCO3;
(5)能提高原料的利用率,减少废渣(CaCl2)的排放,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高; NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2,减少了 CaCO3 制 CO2 这一工序.
解答 解:(1)氮气和氢气的反应在合成塔中进行,因为合成氨反应为可逆反应,反应后化合物中含有一定量的氮气和氢气,分离后再作为原料进行循环利用.
故答案为:合成塔; H2、N2;
(2)用电解法制备氨气,阴极上N2得电子生成NH3,则阴极反应式为N2+6H++6e-═2NH3;
故答案为:N2+6H++6e-═2NH3;
(3)尿素的结构简式为H2NCONH2;在一定条件下,氨气与CO2反应生成H2NCONH2和2H2O,其反应的方程式为:CO2+2NH3$\frac{\underline{\;一定条件\;}}{\;}$H2NCONH2+2H2O;
故答案为:CO2+2NH3$\frac{\underline{\;一定条件\;}}{\;}$H2NCONH2+2H2O;
(4)联合制碱法中CO2来源于石灰石煅烧,石灰石高温分解生成CO2和CaO,氨碱法中CO2的来源于合成氨工业的废气;在沉淀池中NH3、CO2、H2O、NaCl反应生成NH4Cl 和 NaHCO3,则反应方程式为:NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl;
故答案为:碳酸钙高温分解;合成氨厂;NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl;
(5)联合制碱法能提高原料的利用率,减少废渣的排放,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高;NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气CO 转化成 CO2,减少了 CaCO3 制 CO2 这一工序.
故答案为:能提高原料的利用率,减少废渣(CaCl2)的排放,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高;NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2,减少了 CaCO3 制 CO2 这一工序.
点评 本题考查了合成氨、化肥生产及制取纯碱的工业原理,题目难度中等,明确发生的反应原理、电解原理为解答关键,注意掌握合成氨原理、联合制碱法的原理、设备等知识,试题培养了学生的灵活应用能力.

| A. | C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 | B. | Na2O+H2O═2NaOH | ||
| C. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | D. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
| A. | 一定存在Ag+ | B. | 一定存在CO32- | C. | 一定存在SO42- | D. | 以上说法都不对 |
| A. | 1 mol Na2O2与水反应,转移电子1 mol | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应的产物也相同 | |
| C. | 钠能与氧气和水反应,钠暴露在空气中最终的产物是NaOH | |
| D. | 将Na2O2加入酚酞试液中,得到红色溶液 |
| A. | 1:2:3 | B. | 6:3:2 | C. | 3:1:1 | D. | 1:1:1 |
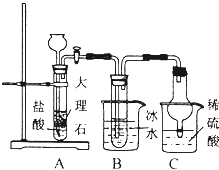 氨气是重要的化工原料.
氨气是重要的化工原料.(1)实验室可用浓氨水和abd(选填编号)快速制取氨气.
a.烧碱 b.生石灰 c.氯化铵d.碱石灰
(2)“侯氏制碱”的核心反应为:
NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3.依据此原理,欲制得碳酸氢钠晶体,某同学设计了如图实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和.
①C装置的作用为防倒吸、吸收过量氨气防污染.
②如表列出的是相关物质在不同温度下的溶解度数据(g/100g水):
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
③该同学在检查完此套装置的气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在AB装置之间(填写字母)连接一个盛有饱和碳酸氢钠溶液的洗气装置,其作用除去二氧化碳气体中的氯化氢气体.
④若该同学进行实验时,所用饱和食盐水中含NaCl的质量为11.7g,实验后得到干燥的NaHCO3晶体的质量为10.92g,则NaHCO3的产率为65%.
(3)往CuSO4溶液中滴加氨水,先有沉淀析出,后沉淀溶解溶液呈深蓝色,有[Cu(NH3)4]2+生成.往溶液中滴加稀硫酸,溶液变为淡蓝色.颜色变浅的原因除溶液变稀外,还可能存在平衡I:[Cu(NH3)4]2+ (深蓝色)+4H+?Cu2+(蓝色)+4NH4+
请设计一个简单实验证明平衡I是否存在往深蓝色溶液中通入少量HCl气体若溶液颜色变浅,证明有平衡Ⅰ的存在,否则不存在(或通入少量氨气或加少量NaOH固体,若溶液颜色变深证明平衡Ⅰ的存在,否则不存在).
| A. | 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 | |
| B. | 向氯化银的悬浊液中加入氯化钠溶液,氯化银的Ksp减小 | |
| C. | 向0.0008mol•L-1的K2CrO4溶液中加入等体积0.002 mol•L-1的AgNO3溶液,则CrO42-完全沉淀 | |
| D. | 将0.001mol•L-1AgNO3溶液滴入浓度均为0.001 mol•L-1的KCl和K2CrO4混合溶液中,则先产生AgCl沉淀 |
| A. | 原料便宜 | B. | CO2参与循环,低碳环保 | ||
| C. | 产生了更多的氯化钙 | D. | 原料利用率高,节省设备 |
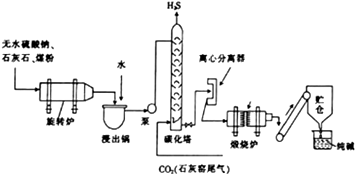 历史上路布兰法生产纯碱的工艺流程如图所示.
历史上路布兰法生产纯碱的工艺流程如图所示.