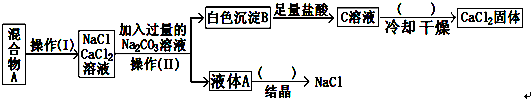
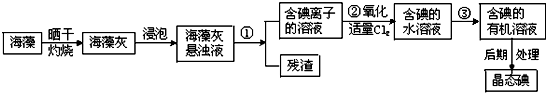
题目内容
(1)Na2CO3固体中混有少量NaHCO3固体,除去的方法是 ,化学方程式为 .
(2)NaHCO3溶液中混有少量Na2CO3,除去的方法是 ,反应的离子方程式为 .
(3)NaOH溶液中混有少量Na2CO3,除去的方法是 ,反应的离子方程式为 .
(4)CO2中混有少量的SO2,除去的方法是 ,反应的化学方程式为 .
(2)NaHCO3溶液中混有少量Na2CO3,除去的方法是
(3)NaOH溶液中混有少量Na2CO3,除去的方法是
(4)CO2中混有少量的SO2,除去的方法是
考点:物质的分离、提纯的基本方法选择与应用,化学方程式的书写
专题:化学实验基本操作
分析:(1)NaHCO3不稳定,可用加热的方法除去;
(2)Na2CO3溶液可与二氧化碳反应生成NaHCO3;
(3)可加入氢氧化钙除杂;
(4)可用饱和碳酸氢钠溶液除杂.
(2)Na2CO3溶液可与二氧化碳反应生成NaHCO3;
(3)可加入氢氧化钙除杂;
(4)可用饱和碳酸氢钠溶液除杂.
解答:
解:(1)NaHCO3不稳定,可用加热的方法除去,方程式为2NaHCO3
Na2CO3+CO2↑+H2O,故答案为:加热;2NaHCO3
Na2CO3+CO2↑+H2O;
(2)NaHCO3溶液中混有少量Na2CO3,除去杂质可用通入过量CO2的方法,反应的离子方程式为CO32-+H2O+CO2═2HCO3-,
故答案为:在溶液中通入过量CO2;CO32-+H2O+CO2═2HCO3-;
(3)除去NaOH溶液中混有的少量Na2CO3,所用试剂为Ca(OH)2,反应的离子方程式为CO32-+Ca2+=CaCO3↓,
故答案为:滴入适量的Ca(OH)2溶液;CO32-+Ca2+=CaCO3↓;
(4)可用饱和碳酸氢钠溶液除杂,方程式为SO2+2NaHCO3═Na2SO3+H2O+2CO2,故答案为:将混合气体通入饱和的NaHCO3溶液;SO2+2NaHCO3═Na2SO3+H2O+2CO2.
| ||
| ||
(2)NaHCO3溶液中混有少量Na2CO3,除去杂质可用通入过量CO2的方法,反应的离子方程式为CO32-+H2O+CO2═2HCO3-,
故答案为:在溶液中通入过量CO2;CO32-+H2O+CO2═2HCO3-;
(3)除去NaOH溶液中混有的少量Na2CO3,所用试剂为Ca(OH)2,反应的离子方程式为CO32-+Ca2+=CaCO3↓,
故答案为:滴入适量的Ca(OH)2溶液;CO32-+Ca2+=CaCO3↓;
(4)可用饱和碳酸氢钠溶液除杂,方程式为SO2+2NaHCO3═Na2SO3+H2O+2CO2,故答案为:将混合气体通入饱和的NaHCO3溶液;SO2+2NaHCO3═Na2SO3+H2O+2CO2.
点评:本题综合考查物质的分离提纯,为高频考点,侧重于物质的性质的考查,注意把握离子方程式的书写,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )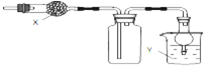

| A、X是碱石灰,收集到的气体是氯化氢,Y是水 |
| B、X是碱石灰,收集到的气体是氨气,Y是水 |
| C、X是氯化钙,搜集到的气体是二氧化硫,Y是氢氧化钠 |
| D、X是氯化钙,收集到的气体是一氧化氮,Y是氢氧化钠 |
茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品正确且完整是( )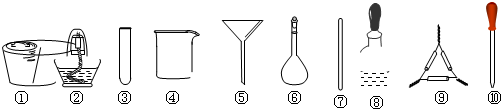

| A、将茶叶灼烧灰化,选用①、② |
| B、用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ |
| C、过滤得到的滤液,选用④、⑤ |
| D、检验滤液中的Fe3+,选用③、⑧、⑩ |
关于Na2O和 Na2O2的叙述中错误的是( )
| A、Na2O是白色固体,Na2O2是淡黄色固体 |
| B、两物质都是碱性氧化物,其中氧元素的化合价都是-2价 |
| C、两者都能和水、二氧化碳、盐酸发生反应 |
| D、Na2O2比Na2O稳定,Na2O在一定条件下可转化为Na2O2 |
下列解释事实的化学用语不正确的是( )
| A、生活中用纯碱做洗涤剂的原理:CO32-+H2O?HCO3-+OH- |
| B、已知某温度和压强下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g)放热19.3KJ,故有:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ?mol-1 |
| C、“NO2球”浸泡在冷水中,颜色变浅:2NO2(g)?N2O4(g)△H<0 |
| D、NaHSO3溶液呈酸性:HSO3-+H2O?SO32-+H3O+ |