题目内容
 已知甲、乙、丙、X、Y为中学化学常见物质,其中甲、乙、丙中均含有元素A,其转化关系如图所示(反应条件已省略):
已知甲、乙、丙、X、Y为中学化学常见物质,其中甲、乙、丙中均含有元素A,其转化关系如图所示(反应条件已省略):(1)若甲是可用于自来水消毒的黄绿色气体,X的水溶液通人二氧化碳能产生白色沉淀,则反应①的用途为
(2)若甲是空气中含量最高的气体,乙的密度小于丙,则一定条件下,反应③的化学方程式为
(3)若甲是蓝色含结晶水的盐,可用于游泳池消毒,甲与X在通电条件下生成的乙为酸,则A的原子结构示意图为
(4)若A是短周期元素,其主族数是周期数的两倍.
①若乙、丙的溶液是常用的调味品,则反应③的化学方程式为
②若甲是单质,乙是氧化物,则气体丙的结构式为
考点:无机物的推断
专题:推断题
分析:(1)甲是可用于自来水消毒的黄绿色气体,应为Cl2,X的水溶液通入二氧化碳能产生白色沉淀,可为Ca(OH)2,乙为Ca(Cl)2和CaCl2的混合物,乙和丙反应生成Cl2,则丙应呈酸性;
(2)甲是空气中含量最高的气体,应为N2,乙和丙中都含有N元素,二者的反应为归中反应,应为NH3和NO的反应;
(3)甲是蓝色含结晶水的盐,可用于游泳池消毒,应为硫酸铜晶体,甲与X在通电条件下生成的乙为酸,则X为水,乙为硫酸,元素A为O,甲溶液中铜离子水解,破坏水的电离平衡,溶液呈酸性;
(4)甲、乙、丙中均含有元素A,A是短周期元素,其主族数是周期数的两倍,则A为ⅣA族或ⅥA族元素,
①若乙、丙的溶液是常用的调味品,应分别为乙酸、乙醇中的一种,反应③是乙酸与乙醇反应生成乙酸乙酯;
②若甲是单质,乙是氧化物,丙为气体,应含有S元素,则X为氧气,甲为硫,乙为SO2,丙为H2S.
(2)甲是空气中含量最高的气体,应为N2,乙和丙中都含有N元素,二者的反应为归中反应,应为NH3和NO的反应;
(3)甲是蓝色含结晶水的盐,可用于游泳池消毒,应为硫酸铜晶体,甲与X在通电条件下生成的乙为酸,则X为水,乙为硫酸,元素A为O,甲溶液中铜离子水解,破坏水的电离平衡,溶液呈酸性;
(4)甲、乙、丙中均含有元素A,A是短周期元素,其主族数是周期数的两倍,则A为ⅣA族或ⅥA族元素,
①若乙、丙的溶液是常用的调味品,应分别为乙酸、乙醇中的一种,反应③是乙酸与乙醇反应生成乙酸乙酯;
②若甲是单质,乙是氧化物,丙为气体,应含有S元素,则X为氧气,甲为硫,乙为SO2,丙为H2S.
解答:
解:甲、乙、丙中均含有元素A,乙和丙中都含有A元素,二者的反应为归中反应,
(1)甲是可用于自来水消毒的黄绿色气体,应为Cl2,X的水溶液通入二氧化碳能产生白色沉淀,可为Ca(OH)2,乙为Ca(Cl)2和CaCl2的混合物,乙和丙反应生成Cl2,反应①常用于制备漂白粉,
故答案为:制备漂白粉;
(2)甲是空气中含量最高的气体,应为N2,乙和丙中都含有N元素,二者的反应为归中反应,应为NH3和NO的反应,反应的方程式为4NH3+6NO
5N2+6H2O,
故答案为:4NH3+6NO
5N2+6H2O;
(3)甲是蓝色含结晶水的盐,可用于游泳池消毒,应为硫酸铜晶体,甲与X在通电条件下生成的乙为酸,则X为水,乙为硫酸,则元素A为O,原子核外电子数为8,有2个电子层,各层电子数为2、8,故其原子结构示意图为: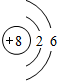 ,硫酸铜溶液中铜离子水解:Cu2++2H2O?Cu(OH)2+2H+,破坏水的电离平衡,溶液呈酸性,
,硫酸铜溶液中铜离子水解:Cu2++2H2O?Cu(OH)2+2H+,破坏水的电离平衡,溶液呈酸性,
故答案为: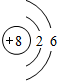 ;Cu2++2H2O?Cu(OH)2+2H+;
;Cu2++2H2O?Cu(OH)2+2H+;
(4)甲、乙、丙中均含有元素A,A是短周期元素,其主族数是周期数的两倍,则A为ⅣA族或ⅥA族元素,
①若乙、丙的溶液是常用的调味品,应分别为乙酸、乙醇中的一种,反应③是乙酸与乙醇反应生成乙酸乙酯,反应方程式为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O;
②若甲是单质,乙是氧化物,丙为气体,应含有S元素,则X为氧气,甲为硫,乙为SO2,丙为H2S,丙的结构式为H-S-H,
故答案为:H-S-H.
(1)甲是可用于自来水消毒的黄绿色气体,应为Cl2,X的水溶液通入二氧化碳能产生白色沉淀,可为Ca(OH)2,乙为Ca(Cl)2和CaCl2的混合物,乙和丙反应生成Cl2,反应①常用于制备漂白粉,
故答案为:制备漂白粉;
(2)甲是空气中含量最高的气体,应为N2,乙和丙中都含有N元素,二者的反应为归中反应,应为NH3和NO的反应,反应的方程式为4NH3+6NO
| ||
故答案为:4NH3+6NO
| ||
(3)甲是蓝色含结晶水的盐,可用于游泳池消毒,应为硫酸铜晶体,甲与X在通电条件下生成的乙为酸,则X为水,乙为硫酸,则元素A为O,原子核外电子数为8,有2个电子层,各层电子数为2、8,故其原子结构示意图为:
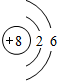 ,硫酸铜溶液中铜离子水解:Cu2++2H2O?Cu(OH)2+2H+,破坏水的电离平衡,溶液呈酸性,
,硫酸铜溶液中铜离子水解:Cu2++2H2O?Cu(OH)2+2H+,破坏水的电离平衡,溶液呈酸性,故答案为:
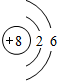 ;Cu2++2H2O?Cu(OH)2+2H+;
;Cu2++2H2O?Cu(OH)2+2H+;(4)甲、乙、丙中均含有元素A,A是短周期元素,其主族数是周期数的两倍,则A为ⅣA族或ⅥA族元素,
①若乙、丙的溶液是常用的调味品,应分别为乙酸、乙醇中的一种,反应③是乙酸与乙醇反应生成乙酸乙酯,反应方程式为:CH3COOH+CH3CH2OH
| 浓硫酸 |
| △ |
故答案为:CH3COOH+CH3CH2OH
| 浓硫酸 |
| △ |
②若甲是单质,乙是氧化物,丙为气体,应含有S元素,则X为氧气,甲为硫,乙为SO2,丙为H2S,丙的结构式为H-S-H,
故答案为:H-S-H.
点评:本题考查无机物的推断,题目难度中等,本题注意根据物质的性质、用途、含量以及原子结构等特点作为突破口,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
据报道,我国科学家首次合成一种新核素镅(
Am),这种新核素同铀(
U)比较,下列叙述正确的是( )
235 95 |
235 92 |
| A、具有相同的原子序数 |
| B、具有相同的中子数 |
| C、具有相同的质量数 |
| D、具有相同的核外电子数 |
下列化学反应及其书写正确的是( )
| A、实验室制备氢氧化铝,用铝盐和过量的氨水:Al3++3OH-=Al(OH)3↓ | ||||
| B、漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2=CaSO3↓+2HClO | ||||
C、铁粉和水蒸气反应:2Fe+3H2O(g)
| ||||
| D、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O |
下列离子方程式正确的是( )
| A、足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O→2HCO3- |
| B、FeSO4溶液在空气中变质:4Fe2++O2+2H2O→4Fe3++4OH- |
| C、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O→2Al(OH)3↓+CO32- |
| D、碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+2Ca2++4OH-→2CaCO3↓+Mg(OH)2↓+2H2O |
 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如图所示.下列判断正确的是( )
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如图所示.下列判断正确的是( )| A、该反应的还原剂是Cl- |
| B、消耗1mol还原剂,转移6mol电子 |
| C、氧化剂与还原剂的物质的量之比为2:3 |
| D、反应后溶液的酸性明显增强 |

 )主要用于配置香辛樱桃、杏、蜂蜜等香料.
)主要用于配置香辛樱桃、杏、蜂蜜等香料.
 (1)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图装置模拟上述过程:
(1)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图装置模拟上述过程: