题目内容
7.下列化学用语正确的是( )| A. | Zn的电子排布式:1s22s22p63s23p64s2 | |
| B. | Fe2+的原子结构示意图: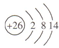 | |
| C. | C的价电子轨道表示式: | |
| D. | HClO的电子式: |
分析 A.Zn原子核外电子数为30,根据能量最低原理书写核外电子排布式;
B.Fe2+的核外电子数为24,核外电子排布式为1s22s22p63s23p63d6,据此画出原子结构示意图;
C.C的价电子排布式为2s22p2,根据洪特规则、泡利原理画出轨道表示式;
D.Cl原子最外层有7个电子,形成1对共用电子对,而氧原子最外层有6个电子,形成2对共用电子对.
解答 解:A.Zn原子核外电子数为30,根据能量最低原理,核外电子排布式为1s22s22p63s23p63d104s2,故A错误;
B.Fe2+的核外电子数为24,核外电子排布式为1s22s22p63s23p63d6,原子结构示意图为 ,故B正确;
,故B正确;
C.C的价电子排布式为2s22p2,价电子轨道表示式为 ,故D错误;
,故D错误;
D.Cl原子最外层有7个电子,形成1对共用电子对,而氧原子最外层有6个电子,形成2对共用电子对,HClO的电子式为 ,故D错误,
,故D错误,
故选:B.
点评 本题考查常用化学用语,涉及核外电子排布式、轨道表示式、原子结构示意图、电子式,D选项为易错点,学生容易受分子式影响,注意根据8电子结构判断原子形成共价键数目.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
17.下列反应过程符合如图所示关系的是( )
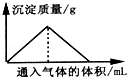

| A. | 向漂白粉溶液中通入CO2气体至过量 | |
| B. | 向Na2SiO3溶液中通入HCl气体至过量 | |
| C. | 向Ba(OH)2和KOH混合溶液中通入CO2气体至过量 | |
| D. | 向NaAlO2溶液中通入HCl气体至过量 |
18.某有机物的蒸气完全燃烧时,需要三倍于其体积的O2,产生二倍于其体积的CO2,则该有机物可能是(体积在同温同压下测定)( )
| A. | C2H4 | B. | CH3CHO | C. | CH3COOH | D. | CH2OHCH2OH |
15.两种金属粉末的混合物9g与足量的稀硫酸反应收集到标准状况下的氢气6.72L,则这种混合物的可能组成是( )
| A. | Mg和Al | B. | Fe和Zn | C. | Fe和Cu | D. | Fe和Al |
2.在PH=1的溶液中,能大量共存的离子组是( )
| A. | Ca2+.Cl-.HCO3-.K+ | B. | Na+.Al3+.Cl-.SO42- | ||
| C. | NH4+.SO32-.Na+ NO3- | D. | Na+.SO42-.[Al(OH)4]-.OH- |
12.PCl5和AlCl3形成的加合物PCl5•AlCl3由[PCl4]+和[AlCl4]-构成.下列有关该加合物的叙述正确的是( )
| A. | 属于分子晶体 | B. | [PCl4]+空间构型为正四面体 | ||
| C. | 阴阳离子均含有配位键 | D. | 固态可导电 |
19.下列物质属于非电解质的是( )
| A. | 氯气 | B. | 醋酸 | C. | 氨气 | D. | 氯化钠溶液 |
16.下列离子方程式正确的是( )
| A. | 向碘化亚铁溶液中滴加溴的四氯化碳溶液2Br2+2Fe2++2I-═I2+4Br-+2Fe3+ | |
| B. | 向含等物质的量浓度AgNO3和Cu(NO3)2的溶液中缓慢加入镁粉4Cu2++2Ag++5Mg═4Cu+2Ag+5Mg2+ | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | 向0.3mol/LNaClO溶液中滴加等体积的0.2mol/LNaHSO3溶液:2HSO3-+4ClO-═2SO42-+2Cl-+2HClO |
16.下列说法中正确的是( )
| A. | 电解质在固态时均为离子晶体 | |
| B. | CCl4、Cl2及HF中的原子都满足最外层8电子稳定结构 | |
| C. | 用道尔顿的原子结构理论无法解释同位素现象 | |
| D. | 晶体类型相同,则晶体中化学键也完全相同 |