题目内容
19.废旧电池的回收利用,既能减少废旧电池对环境的污染,又能实现废旧电池的资源化利用.图1是某科技小组,以废旧锌锰干电池为原料,回收及制备多种用途的碳酸锰和相关物质的主要流程: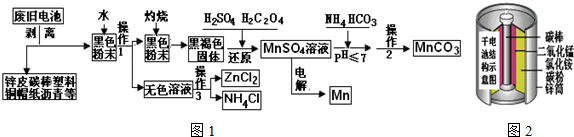
(1)灼烧黑色粉末变成黑褐色是因为有少量MnO2发生了反应生成了少量的MnO,其可能的反应方程式为:2MnO2+C=2MnO+CO2↑或MnO2+C=MnO+CO↑.
(2)还原过程是先加入稀硫酸再加入草酸,写出反应化学方程式:MnO2+H2C2O4+H2SO4=MnSO4+2CO2↑+2H2O;在该过程中小组成员甲发现加入硫酸部分固体溶解剩余黑色固体,接着他没有加入草酸而是加入一定量的双氧水,发现固体也完全溶解了,成员乙在加硫酸后也没有加草酸,他又加入了一定量氨水,无明显变化,测得这时溶液的PH值为9,他接着又加入双氧水,发现黑色固体不减反增,写出导致固体增加的离子方程式:Mn2++H2O2+2OH-=MnO2↓+2H2O;比较甲、乙两位组员实验你得出的结论是:酸性条件下氧化性MnO2>H2O2,碱性条件下氧化性MnO2<H2O2.
(3)操作1和操作2使用到相同的装置,操作3的名称是重结晶.
(4)硫酸锰转化为碳酸锰的操作是,在60摄氏度下调节PH值后加入碳酸氢铵溶液,直到不再有气泡产生后再加热反应1小时,写出反应的化学方程式:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O.
(5)已知锌锰干电池的总反应为Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl+2MnOOH,写出电池正极的电极MnO2+NH4++eˉ=MnO(OH)+NH3;电解MnSO4溶液回收锰的阳极的电极反应式:2H2O-4eˉ=O2↑+4H+(或4OH--4eˉ=O2↑+2H2O).
分析 (1)废旧锌锰干电池剥离出的黑色粉末中含有碳粉和二氧化锰,碳有还原性,在加热时可将二氧化锰还原成氧化锰;
(2)还原过程中草酸将二氧化锰还原成硫酸锰;根据题中现象描述可知,在酸性条件下双氧水能溶解二氧化锰,说明二氧化锰能氧化双氧水,在碱性条件下,加入双氧水,发现黑色固体不减反增,说明溶液中的锰离子变成了二氧化锰,即双氧水将锰离子氧化成了二氧化锰,据此分析;
(3)操作1和操作2都是分离固体和液体,都使用过滤的装置,操作3是分离氯化锌和氯化铵,用重结晶的方法;
(4)硫酸锰中加入碳酸氢铵溶液生成碳酸锰,同时有气泡产生应为二氧化碳,根据元素守恒可书写化学方程式;
(5)在锌锰干电池中,二氧化锰是氧化剂,在正极发生还原反应生成MnOOH,电解MnSO4溶液时,阳极上是水电离出的氢氧根离子放电生成氧气,阴极上是锰离子得电子生成锰,据此答题.
解答 解:(1)废旧锌锰干电池剥离出的黑色粉末中含有碳粉和二氧化锰,碳有还原性,在加热时可将二氧化锰还原成氧化锰,反应的化学方程式为2MnO2+C=2MnO+CO2↑或MnO2+C=MnO+CO↑,
故答案为:2MnO2+C=2MnO+CO2↑或MnO2+C=MnO+CO↑;
(2)还原过程中草酸将二氧化锰还原成硫酸锰,反应方程式为MnO2+H2C2O4+H2SO4=MnSO4+2CO2↑+2H2O,根据题中现象描述可知,在酸性条件下双氧水能溶解二氧化锰,说明二氧化锰能氧化双氧水,在碱性条件下,加入双氧水,发现黑色固体不减反增,说明溶液中的锰离子变成了二氧化锰,即双氧水将锰离子氧化成了二氧化锰,反应方程式为Mn2++H2O2+2OH-=MnO2↓+2H2O,比较甲、乙两位组员实验可得出的结论是酸性条件下氧化性MnO2>H2O2,碱性条件下氧化性MnO2<H2O2,
故答案为:MnO2+H2C2O4+H2SO4=MnSO4+2CO2↑+2H2O;Mn2++H2O2+2OH-=MnO2↓+2H2O;酸性条件下氧化性MnO2>H2O2,碱性条件下氧化性MnO2<H2O2;
(3)操作1和操作2都是分离固体和液体,都使用过滤的装置,操作3是分离氯化锌和氯化铵,用重结晶的方法,
故答案为:重结晶;
(4)硫酸锰中加入碳酸氢铵溶液生成碳酸锰,同时有气泡产生应为二氧化碳,反应的化学方程式为MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O,
故答案为:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O;
(5)在锌锰干电池中,二氧化锰是氧化剂,在正极发生还原反应生成MnOOH,电极反应式为MnO2+NH4++eˉ=MnO(OH)+NH3,电解MnSO4溶液时,阳极上是水电离出的氢氧根离子放电生成氧气,阴极上是锰离子得电子生成锰,阳极的电极反应式为2H2O-4eˉ=O2↑+4H+(或4OH--4eˉ=O2↑+2H2O),
故答案为:MnO2+NH4++eˉ=MnO(OH)+NH3;2H2O-4eˉ=O2↑+4H+(或4OH--4eˉ=O2↑+2H2O).
点评 本题考查了物质制备方案设计,为高频考点,侧重于学生的分析、实验能力的考查,题目涉及离子方程式的书写、电极反应式的书写、氧化还原反应等知识,题目难度中等,注意把握实验的流程以及相关物质的性质.

 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案| A. | A的金属性强于B | |
| B. | 电子不断由A电极经外电路流向B电极 | |
| C. | A电极上发生的电极反应是还原反应 | |
| D. | A的金属活动性一定排在氢前面 |

| A. | 金刚石转变为石墨是吸热反应 | |
| B. | S(g)+O2(g)═SO2(g)△H1,S(s)+O2(g)═SO2(g)△H2,则△H1>△H2 | |
| C. | 白磷比红磷稳定 | |
| D. | CO(g)+H2O(g)═CO2(g)+H2(g)△H<0 |
 化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.(1)下列△H表示物质燃烧热的是△H4、△H5;表示物质中和热的是△H6.(填“△H1”、“△H2”和“△H3”等)
A.2H2(g)+O2(g)=2H2O(l)△H1
B.C(s)+1/2O2(g)=CO(g)△H2
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3
D.C(s)+O2(g)=CO2(g)△H4
E.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H7
(2)已知在101kPa、273K时,15g乙烷燃烧生成CO2和液态水,放出akJ的热量,下列热化学方程式正确的是C.
A.C2H6(g)+$\frac{7}{2}$O2(g)=2CO2(g)+3H2O(l)△H=+2akJ/mol
B.C2H6(g)+$\frac{7}{2}$/2O2(g)=2CO2(g)+3H2O(g)△H=-2akJ/mol
C.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H=-4akJ/mol
D.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)△H=-4akJ/mol
(3)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关(键能可以简单地理解为断开1mol化学键时所需吸收的能量),如表是部分化学键的键能数据:
| 化学键 | P-P | P-O | O═O | P═O |
| 键能KJ/mol | 197 | 360 | 499 | a |
(4)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ/mol.
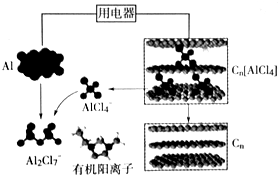
| A. | 充电时,Al做阴极、Cn为阳极 | |
| B. | 充电时,每生成1mol铝,同时消耗4molAl2Cl7- | |
| C. | 放电时,电解质中的有机阳离子向铝电极方向移动 | |
| D. | 放电时,正极反应式为Cn[AlCl4]+e-=Cn+AlCl4- |
| A. | 酸性氧化物、非金属氧化物 | B. | 胶体、分散系 | ||
| C. | 含氧酸、酸 | D. | 化合物、非电解质 |
| A. | 乙酸乙酯的结构简式:CH3CH2COOCH3 | |
| B. | 丙烯的键线式 | |
| C. | 乙醇的结构式: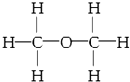 | |
| D. | 乙烯的结构简式:CH2=CH2 |
(2)A、B、C为同一短周期金属元素.依据下表数据分析,C元素在化合物中的主要化合价为+3;A、B、C三种元素的原子半径由大到小的顺序是A>B>C.
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| C | 580 | 1800 | 2700 | 11600 |
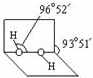 分子中氧原子采取sp3杂化;通常情况下,H2O2与水任意比互溶的主要原因是H2O2分子与水分子间形成氢键,使H2O2与水任意比互溶.
分子中氧原子采取sp3杂化;通常情况下,H2O2与水任意比互溶的主要原因是H2O2分子与水分子间形成氢键,使H2O2与水任意比互溶.(4)R是1~36号元素中未成对电子数最多的原子.R3+在溶液中存在如下转化:
R3+$?_{H+}^{OH-}$R(OH)3$?_{H+}^{OH-}$[R(OH)4]-
①基态R原子的价电子排布式为3d54s1.
②[R(OH)4]-中存在的化学键是BD.
A.离子键 B.极性键 C.非极性键 D.配位键
(5)等电子体原理可广义理解为:重原子数相等(重原子指原子序数≥4的原子),总电子数或价电子数相等的分子或离子.若将H2O2滴入液氨中,可得白色固体A,红外光谱显示,A中有阴阳两种离子,阳离子是正四面体,阴离子与H2O2互为等电子体.则A的结构简式为NH4OOH.