题目内容
常温下,下列溶液中的微粒浓度关系不正确的是( )
| A、pH=5.3的NaHSO3溶液:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3) |
| B、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C、0.1mol?L-1 Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+2 c(H2CO3) |
| D、物质的量浓度相等的NH3?H2O和NH4Cl溶液等体积混合:c(Cl-)=c(NH3?H2O)+c(NH4+) |
考点:离子浓度大小的比较
专题:
分析:A、pH=5.3的NaHSO3溶液显示酸性,则亚硫酸氢根离子的水解程度小于电离程度;
B、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,醋酸剩余,还会生成醋酸钠溶液;
C、根据溶液中的质子守恒来计算;
D、根据溶液中的物料守恒来回.
B、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,醋酸剩余,还会生成醋酸钠溶液;
C、根据溶液中的质子守恒来计算;
D、根据溶液中的物料守恒来回.
解答:
解:A、pH=5.3的NaHSO3溶液显示酸性,则亚硫酸氢根离子的水解程度小于电离程度,即c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),故A正确;
B、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,醋酸剩余,还会生成醋酸钠溶液,溶液显示酸性,即c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B正确;
C、0.1mol?L-1 Na2CO3溶液存在质子守恒:c(OH-)=c(H+)+c(HCO3-)+2 c(H2CO3),故C正确;
D、物质的量浓度相等的NH3?H2O和NH4Cl溶液等体积混合:2c(Cl-)=c(NH3?H2O)+c(NH4+),故D错误.
故选D.
B、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,醋酸剩余,还会生成醋酸钠溶液,溶液显示酸性,即c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B正确;
C、0.1mol?L-1 Na2CO3溶液存在质子守恒:c(OH-)=c(H+)+c(HCO3-)+2 c(H2CO3),故C正确;
D、物质的量浓度相等的NH3?H2O和NH4Cl溶液等体积混合:2c(Cl-)=c(NH3?H2O)+c(NH4+),故D错误.
故选D.
点评:本题考查了弱电解质电离平衡,盐类水解的应用,溶液酸碱性的分析判断,溶液离子浓度大小比较等知识,题目难度中等.

练习册系列答案
相关题目
短周期元素X、Y的单质分别为M、N,在水溶液中发生置换反应:M+化合物(Ⅰ)=N+化合物(Ⅱ)(反应条件省略),下列推断不正确的是( )
| A、若X为金属,Y为非金属,则X和Y可能位于周期表中不同主族 |
| B、若X为非金属,Y为非金属,则X和Y一定位于周期表中同一主族 |
| C、若M、N在常温下呈气态,则X、Y不可能位于同一主族 |
| D、若在常温下,M为气态,N为固态,则X、Y可能位于同一周期 |
电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去.下列说法不正确的是( )
A、电路中每转移12 mol电子,最多有 2 mol Cr2O
| ||
| B、阳极反应为Fe-2e-═Fe2+ | ||
| C、电解过程中溶液pH增大 | ||
| D、电解过程中有Fe(OH)3沉淀生成 |
下列说法不正确的是( )
| A、纸层析点样时,用胶头滴管吸取试液,滴3-5滴在滤纸条的原点处,晾干备用 |
| B、在闻气体气味时,面部应远离容器用手轻轻扇动瓶口,仅使少量气体飘进鼻孔 |
| C、变色硅胶是实验室常用的干燥剂,其中的变色剂是氯化钴(CoCl2),变色硅胶吸湿效果最好时所呈现的颜色是蓝色 |
| D、比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速度快慢时,可以加K8[Fe(CN)6]溶液,观察铁钉周围出现蓝色沉淀的先后 |
下列说法正确的是( )
| A、“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 |
| B、氢能的开发和应用只要解决氢气的贮存和运输问题即可大规模的应用 |
| C、氢氧化铁溶胶、甘油与乙醇的混合液、含PM2.5的大气均具有丁达尔效应 |
| D、核磁共振仪可以区分正丁烷和异丁烷 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、能使甲基橙试液显红色的溶液:Na+、NH4+、Fe2+、NO3- |
| B、含Fe3+的溶液:NH4+、K+、SCN-、Cl- |
| C、由水电离出来的c(H+)=1×10-13mol.L-1的溶液中:K+、CH3COO-、Cl-、NO3- |
| D、常温下,KW/C(H+)=0.01mol.L-1的溶液:K+、Cl-、CO32-、Na+ |
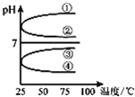 A、B、C、D、E五种溶液分别是NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验: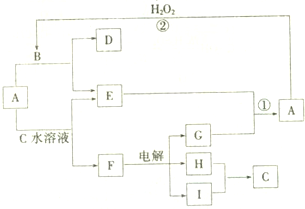 A-I均为中学化学常见的物质,其转化关系如图所示(部分产物已略去).已知:A为酸式盐,且A是焰色反应为紫色(透过蓝色钴玻璃);B与A的组成元素完全相同;C、E、H、I为气体,且H、I为单质.
A-I均为中学化学常见的物质,其转化关系如图所示(部分产物已略去).已知:A为酸式盐,且A是焰色反应为紫色(透过蓝色钴玻璃);B与A的组成元素完全相同;C、E、H、I为气体,且H、I为单质.