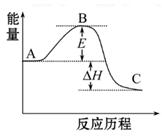
题目内容
(9分)(1)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为_________________________________________________。
(2)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
| 化学键 | C—H | C—F | H—F | F—F |
| 键能 | 414 | 489 | 565 | 158 |
CH4(g)+4F2(g)= CF4(g)+4HF(g) △H=______________________。
(3) 下列说法正确的是(填序号)__ __:
A 相同温度下,0.1 mol?L-1NH4Cl溶液中NH4+的浓度比0.1 mol?L-1氨水中NH4+的浓度大;
B 用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
C 电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气;
D 对于Al(OH)3(s)
 Al(OH)3(aq)
Al(OH)3(aq) Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡;
Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡;E.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3的大;
(1)CH4(g) + 2O2 (g)="==" CO2 (g)+2H2O(l) △H= —889.6kJ/mol
(2)△H= —1928kJ/mol (3)A、B、D
解析试题分析:(1)甲烷的相对分子质量是16,所以1mol的甲烷完全燃烧放出的热量是55.6kJ ×16g/mol =889.6kJ。因此表示甲烷燃烧热的热化学方程式为CH4(g) + 2O2 (g)="=" CO2 (g)+2H2O(l) △H= —889.6kJ/mol;(2)4mol×414KJ/mol+4×158KJ/mol-4×489 KJ/mol-4×565 KJ/mol=—1928kJ,所以该反应的反应热△H= —1928kJ/mol。(3)A.由于NH4Cl是强电解质,完全电离,尽管NH4+水解消耗,但是水解程度是微弱的;而NH3·H2O是弱电解质,电离程度很小,因此等浓度的1NH4Cl溶液中NH4+的浓度比氨水中NH4+的浓度大,正确;B. 用稀盐酸洗涤AgCl沉淀时由于溶液中Cl-的浓度比水大,会抑制AgCl的溶解,使其溶解消耗的少,所以比用水洗涤损耗AgCl小;正确;C.电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气;错误;D. 对于Al(OH)3(s) Al(OH)3(aq)
Al(OH)3(aq) Al3+(aq) +3OH-(aq),前段为沉淀溶解平衡,后段是溶解的弱电解质Al(OH)3的电离平衡;正确;E. 除去溶液中的Mg2+,由于Mg(OH)2的溶解度比MgCO3小,所以用OH-沉淀Mg2+比用CO32-效果好,错误。
Al3+(aq) +3OH-(aq),前段为沉淀溶解平衡,后段是溶解的弱电解质Al(OH)3的电离平衡;正确;E. 除去溶液中的Mg2+,由于Mg(OH)2的溶解度比MgCO3小,所以用OH-沉淀Mg2+比用CO32-效果好,错误。
考点:考查燃烧热很小方程式的书写、反应热与键能的关系、离子浓度的比较、沉淀溶解平衡、电离平衡、杂质的除去的知识。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案参照反应Br + H2 HBr +H的能量对反应历程的示意图,下列对上述正反应叙述中正确的
HBr +H的能量对反应历程的示意图,下列对上述正反应叙述中正确的 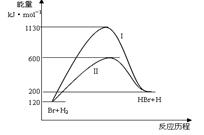
| A.反应热:过程I>过程Ⅱ |
| B.反应速率:过程Ⅱ=过程I |
| C.该反应为吸热反应 |
| D.过程I使用了催化剂 |
下列有关说法不正确的是:
A.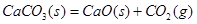 室温下不能自发进行,说明该反应的 室温下不能自发进行,说明该反应的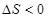 |
| B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
C.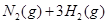  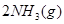 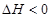 ,其他条件不变时升高温度,反应速率v(H2)和v(NH3)均增大 ,其他条件不变时升高温度,反应速率v(H2)和v(NH3)均增大 |
| D.水的离子积常数KW随着温度的升高而增大,说明水的电离是吸热过程 |
(11 分)(原创)能源是人类生存和发展的重要支柱,研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义,已知下列热化学方程式
| | ① | H2(g)+ O2(g)= H2O(g) △H =﹣242kJ/mol; O2(g)= H2O(g) △H =﹣242kJ/mol; | ||||||||
| | ② | 2H2(g)+ O2(g)= 2H2O(l) △H =﹣572kJ/mol; | ||||||||
| | ③ | C(s)+ O2(g)= CO(g) △H =﹣110.5kJ/moL; O2(g)= CO(g) △H =﹣110.5kJ/moL; | ||||||||
| | ④ | C(s)+ O2(g)= CO2(g) △H =﹣393.5kJ/moL; | ||||||||
| | ⑤ | CO2(g)+ 2H2O(g)= CH4(g)+ 2O2(g)△H =" +" 802kJ/moL | ||||||||
| 化学键 | O=O | C-C | H-H | O-O | C-O | O-H | C-H | | ||
| 键能kJ/mol | 497 | 348 | 436 | 142 | 351 | 463 | 414 | | ||
(1)写出能表示H2燃烧热的热化学方程式 。
(2)已知C(s)+ H2O(g)
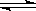 H2(g)+ CO(g)△H =" ___________" kJ/moL;
H2(g)+ CO(g)△H =" ___________" kJ/moL; (3)估算出C=O键能为 kJ/moL。
(4)CH4的燃烧热△H = — ___________ kJ/moL。
(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开1L水所需要的CH4的物质的量为_________mol[保留到小数点后2位;已知:c (H2O)=4.2J/(g·℃) ]。
(15分)碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g) 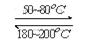 Ni(CO)4(g),
Ni(CO)4(g), H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
(填字母编号)。
| A.增加Ni的量可提高CO的转化率,Ni的转化率降低 |
B.缩小容器容积,平衡右移, H减小 H减小 |
| C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低 |
| D.当4vNi(CO)4=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态 |
已知:C(s)+
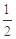 O2(g)==CO(g)
O2(g)==CO(g)  H= -Q1 kJ·mol-1
H= -Q1 kJ·mol-1C(s)+ O2(g)==CO2(g)
 H= -Q2 kJ·mol-1
H= -Q2 kJ·mol-1S(s)+O2(g)==SO2(g)
 H= -Q3 KJ·mol-1
H= -Q3 KJ·mol-1则SO2(g)+2CO(g)==S(s)+2CO2(g)
 H= kJ·mol-1。
H= kJ·mol-1。(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图(1)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时
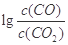 与温度(t)的关系曲线图。
与温度(t)的关系曲线图。700oC时,其中最难被还原的金属氧化物是 (填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于 。

(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图(2)所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为 L。
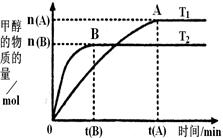
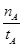 mol·L-1·min-1
mol·L-1·min-1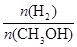 增大
增大 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1
 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1