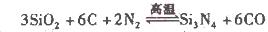题目内容
(11 分)(原创)能源是人类生存和发展的重要支柱,研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义,已知下列热化学方程式
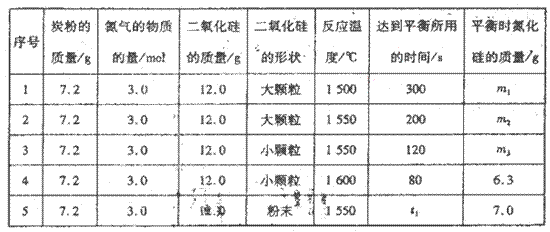
| | ① | H2(g)+ O2(g)= H2O(g) △H =﹣242kJ/mol; O2(g)= H2O(g) △H =﹣242kJ/mol; | ||||||||
| | ② | 2H2(g)+ O2(g)= 2H2O(l) △H =﹣572kJ/mol; | ||||||||
| | ③ | C(s)+ O2(g)= CO(g) △H =﹣110.5kJ/moL; O2(g)= CO(g) △H =﹣110.5kJ/moL; | ||||||||
| | ④ | C(s)+ O2(g)= CO2(g) △H =﹣393.5kJ/moL; | ||||||||
| | ⑤ | CO2(g)+ 2H2O(g)= CH4(g)+ 2O2(g)△H =" +" 802kJ/moL | ||||||||
| 化学键 | O=O | C-C | H-H | O-O | C-O | O-H | C-H | | ||
| 键能kJ/mol | 497 | 348 | 436 | 142 | 351 | 463 | 414 | | ||
(1)写出能表示H2燃烧热的热化学方程式 。
(2)已知C(s)+ H2O(g)
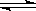 H2(g)+ CO(g)△H =" ___________" kJ/moL;
H2(g)+ CO(g)△H =" ___________" kJ/moL; (3)估算出C=O键能为 kJ/moL。
(4)CH4的燃烧热△H = — ___________ kJ/moL。
(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开1L水所需要的CH4的物质的量为_________mol[保留到小数点后2位;已知:c (H2O)=4.2J/(g·℃) ]。
(11分,除特殊注明外每空2分)
(1) (2)+ 131.5
(2)+ 131.5
(3)800 (4)890 (5)0.56(3分)
解析试题分析:(1)25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热,根据2H2(g)+ O2(g)= 2H2O(l) △H =﹣572kJ?mol?1可得能表示H2燃烧热的热化学方程式为: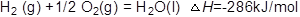 。
。
(2)根据盖斯定律,C(s)+ H2O(g)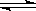 H2(g)+ CO(g)可由③—①所得,则?H=?H3—?H1=+ 131.5kJ?mol?1。
H2(g)+ CO(g)可由③—①所得,则?H=?H3—?H1=+ 131.5kJ?mol?1。
(3)设C=O键能为x,根据CO2(g)+ 2H2O(g)= CH4(g)+ 2O2(g)△H =" +" 802kJ/moL,可得关系式:2x+4×463—4×414—2×497=802,解得x=800。
(4)表示CH4燃烧热的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l),?H,根据盖斯定律,该反应等效于—①×2+②—⑤,带入各反应的焓变可得?H=—890kJ?mol?1。
(5)根据反应的热效应,n(CH4)×890000J?mol?1×90%×70%=1000g×(100℃—25℃)×4.2J/(g·℃),解得n(CH4)=0.56mol。
考点:本题考查盖斯定律及热化学方程式、燃烧热、键能的计算、化学反应与能量的计算。

下列反应中属吸热反应的是
| A.铝与盐酸反应放出氢气 | B.氢氧化钠与盐酸的反应 |
| C.硫在空气或氧气中燃烧 | D.Ba(OH)2·8H2O与NH4Cl反应 |
(9分)(1)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为_________________________________________________。
(2)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
| 化学键 | C—H | C—F | H—F | F—F |
| 键能 | 414 | 489 | 565 | 158 |
CH4(g)+4F2(g)= CF4(g)+4HF(g) △H=______________________。
(3) 下列说法正确的是(填序号)__ __:
A 相同温度下,0.1 mol?L-1NH4Cl溶液中NH4+的浓度比0.1 mol?L-1氨水中NH4+的浓度大;
B 用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
C 电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气;
D 对于Al(OH)3(s)
 Al(OH)3(aq)
Al(OH)3(aq) Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡;
Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡;E.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3的大;
已知;①Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
②Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=b kJ·mol-1。
测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
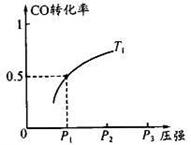
(2)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为 。
(3)下列关于反应①的说法正确的是 。
A.达到平衡后保持其他条件不变,升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B. 在500 ℃下反应,当c(CO2)=c(CO)时,反应达到平衡状态
C.恒温恒容下,当容器内气体密度不再变化时,反应达到平衡状态
D.加压、升温和使用催化剂均可增大反应物的转化率
(4)由已知反应,写出Fe2O3(s)被CO(g)还原成FeO(s)的热化学方程式 。
(5)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)=__________mol·L-1(已知:Ksp[Fe(OH)3]=4.0×10-36)。
(6)新型锌空电池与锂电池相比,具有能量密度高、安全性好且成本低。该电池的总反应为2Zn+O2===2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为_______。
若以该电池为电源,用惰性电极电解硫酸铜溶液,为保证阴极有6.4g铜析出,理论上至少需要标准状况下 L空气(空气中含氧气按20%计算)进入该电池。
下列依据热化学方程式得出的结论正确的是
| A.已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ·mol-1,则氢气的燃烧热(△H)为—241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ·mol-1,则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3kJ的热量 |
| C.己知2C(s)+2O2(g)=2CO2(g)△H = a;2C(s)+O2(g)=2CO(g);△H = b,则a>b |
| D.已知C (石墨,s)="C" (金刚石,s)△H>0,则石墨比金刚石稳定 |
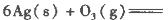
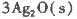 反应生成3 mol Ag2O(s)时放出的热量为
反应生成3 mol Ag2O(s)时放出的热量为
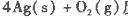 反应生成4 mol Ag(s)时吸收的热量为62.2 kJ,试根据题给数据判断O3转化为O2是________(填“放热”或“吸热”)反应。
反应生成4 mol Ag(s)时吸收的热量为62.2 kJ,试根据题给数据判断O3转化为O2是________(填“放热”或“吸热”)反应。