题目内容
2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1
请回答下列问题:
(1)图中A、C分别表示_________、_________,E的大小对该反应 的反应热有无影响?_________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________,理由是__________________;(2)图中ΔH=_________kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒氧化物VO2;四价钒氧化物再被氧气氧化。写出该催化循环机理的化学方程式_____________________________;
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3mol SO3(g)的ΔH_______(要求计算过程)。
(1)反应物能量 生成物能量 没有影响 降低 因为催化剂改变了反应历程,使活化能E降低
(2)-198
(3)SO2+V2O5====SO3+2VO2 4VO2+O2====2V2O5
(4) -1 185 kJ·mol-1
解析试题分析:本题考查化学反应中的能量变化、盖斯定律、反应速率计算及催化剂的催化原理。(1)由图象知A、C点分别代表反应物、产物的总能量,E为反应的活化能,因反应历程不同而不同,但对反应热无影响;催化剂的加入,改变了反应历程,降低了反应的活化能,从而加快了反应速率。(2)由已知数据可知ΔH="-99" kJ·mol-1×2="-198" kJ·mol-1。 (4硫的燃烧热为296 kJ·mol-1,可得S(s)+O2(g)====SO2(g),ΔH="-296" kJ·mol-1,结合2SO2(g)+O2(g) 2SO3(g),ΔH="-198" kJ·mol-1,利用盖斯定律,即可求得由S(s)生成3 mol SO3(g)的ΔH。
2SO3(g),ΔH="-198" kJ·mol-1,利用盖斯定律,即可求得由S(s)生成3 mol SO3(g)的ΔH。
S(s)+O2(g)====SO2(g) △H1="-296" kJ·mol-1①
SO2(g)+ O2(g)====SO3(g) △H2="-99" kJ·mol-1②
O2(g)====SO3(g) △H2="-99" kJ·mol-1②
①×3+②×3得
3S(s)+ O2(g)====3SO3(g) ΔH=(ΔH1+ΔH2)×3="-1" 185 kJ·mol-1
O2(g)====3SO3(g) ΔH=(ΔH1+ΔH2)×3="-1" 185 kJ·mol-1
考点:考查化学反应与能量、盖斯定律、反应速率计算及催化剂的催化原理相关知识点

 名校课堂系列答案
名校课堂系列答案已知反应A+B= C+D的能量变化如下图所示,下列说法正确的是
| A.该反应是放热反应 |
| B.只有在加热条件下才能进行 |
| C.反应物的总能量高于生成物的总能量 |
| D.反应中断开化学键吸收的总能量高于形成化学键放出的总能量 |
下列有关热化学方程式的叙述正确的是 ( )
| A.已知2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol,则氢气的燃烧热为-285.8 kJ/mol |
| B.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| C.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ/mol |
| D.已知2C(s)+2O2(g)===2CO2(g) ΔH1;2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1>ΔH2 |
(14分)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
①CO(g)+H2O(g)  CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
(2)容器①中反应达平衡时,CO的转化率为 %。
(3)计算容器②中反应的平衡常数K= 。
(4)下列叙述正确的是 (填字母序号)。
A.平衡时,两容器中H2的体积分数相等
B.容器②中反应达平衡状态时,Q > 65.6 kJ
C.反应开始时,两容器中反应的化学反应速率相等
D.容器①中,化学反应速率为:

(5)已知:②2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2的热化学方程式: 。
(6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示) 。
(7)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用图中所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。

①写出阳极所发生反应的电极反应式: 。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合反应式解释) 。
(9分)(1)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为_________________________________________________。
(2)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
| 化学键 | C—H | C—F | H—F | F—F |
| 键能 | 414 | 489 | 565 | 158 |
CH4(g)+4F2(g)= CF4(g)+4HF(g) △H=______________________。
(3) 下列说法正确的是(填序号)__ __:
A 相同温度下,0.1 mol?L-1NH4Cl溶液中NH4+的浓度比0.1 mol?L-1氨水中NH4+的浓度大;
B 用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
C 电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气;
D 对于Al(OH)3(s)
 Al(OH)3(aq)
Al(OH)3(aq) Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡;
Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡;E.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3的大;
(4分)拆开1mol气态物质中某种共价键需要吸收的能量,就是该共价键的键能。下表是某些共价键的键能:
| 共价键 | H-H | O=O | H-O |
| 键能/kJ ·mol-1 | 436 | 498 | X |

(1) 图中:a=___________。
(2) 表格中:X= 。

 AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。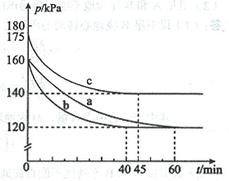
 CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):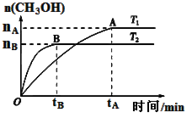
 2H2O + 。
2H2O + 。