题目内容
Ⅰ顺铂是美国教授B Rosenberg等人于1969年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2.
(1)与氮元素处于同一周期且相邻的两种元素分别是 ,这三种元素的第一电离能由大到小的顺序是 ,电负性由小到大的顺序是 .
(2)与NH3互为等电子体的分子、离子有 、 (各举一例).
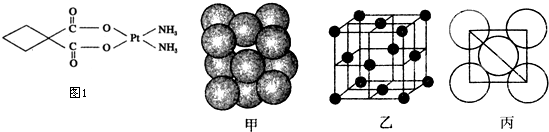
(3)碳铂是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,是第二代铂族抗癌药物,其毒副作用低于顺铂.碳铂的结构如图1:
碳铂分子中含有的作用力有 (填字母).
A.极性共价键 B.非极性共价键 C.配位键 D.离子键
E.金属键 F.σ键 G.π键
(4)碳铂中C原子的杂化方式有 .
(5)铂(Pt)单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.
晶胞中铂(Pt)原子的配位数为 .若已知铂(Pt)的摩尔质量为M g/mol,阿伏加德罗常数为NA,Pt原子半径为b pm,则该晶胞的密度为ρ= g/cm3.(用含M、NA、b的计算式表示,不用化简).
Ⅱ.原子序数小于36的元素A和B,在周期表中既处于同一周期又位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子,B元素在周期表中的位置为 ,A2+在基态时外围电子(价电子)占据的能层符号为 ,外围电子(价电子)排布式 .

(1)与氮元素处于同一周期且相邻的两种元素分别是
(2)与NH3互为等电子体的分子、离子有
(3)碳铂是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,是第二代铂族抗癌药物,其毒副作用低于顺铂.碳铂的结构如图1:
碳铂分子中含有的作用力有
A.极性共价键 B.非极性共价键 C.配位键 D.离子键
E.金属键 F.σ键 G.π键
(4)碳铂中C原子的杂化方式有
(5)铂(Pt)单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.
晶胞中铂(Pt)原子的配位数为
Ⅱ.原子序数小于36的元素A和B,在周期表中既处于同一周期又位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子,B元素在周期表中的位置为
考点:晶胞的计算,元素周期表的结构及其应用,位置结构性质的相互关系应用,配合物的成键情况,“等电子原理”的应用,原子轨道杂化方式及杂化类型判断,不同晶体的结构微粒及微粒间作用力的区别
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:Ⅰ.(1)与氮元素处于同一周期且相邻的两种元素为C、O,非金属性越强,电负性越大,第一电离能越大,但N的2p电子半满为稳定状态;
(2)氨气分子含4个原子,价电子数为5+3=8,等电子体中价电子数相等且原子个数相等;
(3)同种非金属元素之间易形成非极性共价键,不同非金属元素之间易形成极性共价键,提供空轨道的原子和提供孤电子对的原子之间易形成配位键;
(4)根据原子中含有的价层电子对数判断杂化方式;
(5)采用沿X、Y、Z三轴切割的方法确定配位数;均摊法计算原子个数、由原子半径计算棱长,结合ρ=
计算;
Ⅱ.原子序数小于36的元素A和B,在周期表中既处于同一周期又位于同一族,则A、B只能处于第VIII族,原子序数B比A多1,基态B原子中含有三个未成对电子,则B是Co元素,A是Fe元素.
(2)氨气分子含4个原子,价电子数为5+3=8,等电子体中价电子数相等且原子个数相等;
(3)同种非金属元素之间易形成非极性共价键,不同非金属元素之间易形成极性共价键,提供空轨道的原子和提供孤电子对的原子之间易形成配位键;
(4)根据原子中含有的价层电子对数判断杂化方式;
(5)采用沿X、Y、Z三轴切割的方法确定配位数;均摊法计算原子个数、由原子半径计算棱长,结合ρ=
| M |
| V |
Ⅱ.原子序数小于36的元素A和B,在周期表中既处于同一周期又位于同一族,则A、B只能处于第VIII族,原子序数B比A多1,基态B原子中含有三个未成对电子,则B是Co元素,A是Fe元素.
解答:
解:(1)与氮元素处于同一周期且相邻的两种元素为C、O,非金属性越强,电负性越大,则电负性为C<N<O;非金属性越强,第一电离能越大,但N的2p电子半满为稳定状态,则第一电离能为N>O>C,故答案为:C、O;N>O>C;C<N<O;
(2)氨气分子中含有4个原子,价电子数是5+3=8,与NH3互为等电子体的分子如PH3或AsH3,与NH3互为等电子体的离子如H3O+或CH3-,故答案为:PH3或AsH3;H3O+或CH3-;
(3)根据其结构知,碳原子和氧原子之间或氮原子和氢原子之间都形成极性共价键,碳原子和碳原子之间存在非极性共价键,铂和碳原子或氮原子之间存在配位键,碳碳单键或氮氢键等都是σ键,碳氧原子间有一个σ键一个π键,故选ABCFG;
(4)碳原子有的含有3个σ键一个π键,有的含有4个σ键,所以碳原子采取sp2和sp3杂化,故答案为:sp3和sp2;
(5)由甲图可知,采用沿X、Y、Z三轴切割的方法确定配位数,每个切割面上的配位数是4,共有3个切割面,所以其配位数是12,或由乙图可知,与顶点最近的原子在面心,则配位数为
=12;Pt原子半径为b pm,由丙图可知,晶胞棱长为2
bpm,由乙可知,晶胞中原子个数为8×
+6×
=4,由ρ=
可知,该晶胞的密度为ρ=
=
g/cm3,故答案为:12;
;
Ⅱ.原子序数小于36的元素A和B,在周期表中既处于同一周期又位于同一族,则A、B只能处于第VⅢ族,原子序数B比A多1,基态B原子中含有三个未成对电子,则B是Co元素,B是第四周期第VIII族;A是Fe元素,铁失去4s能级上2个电子,导致d能级上的电子为其价电子,所以亚铁离子的价电子排布式为3d6,占据的能层符号3d;
故答案为:第四周期Ⅷ族;3d;3d6.
(2)氨气分子中含有4个原子,价电子数是5+3=8,与NH3互为等电子体的分子如PH3或AsH3,与NH3互为等电子体的离子如H3O+或CH3-,故答案为:PH3或AsH3;H3O+或CH3-;
(3)根据其结构知,碳原子和氧原子之间或氮原子和氢原子之间都形成极性共价键,碳原子和碳原子之间存在非极性共价键,铂和碳原子或氮原子之间存在配位键,碳碳单键或氮氢键等都是σ键,碳氧原子间有一个σ键一个π键,故选ABCFG;
(4)碳原子有的含有3个σ键一个π键,有的含有4个σ键,所以碳原子采取sp2和sp3杂化,故答案为:sp3和sp2;
(5)由甲图可知,采用沿X、Y、Z三轴切割的方法确定配位数,每个切割面上的配位数是4,共有3个切割面,所以其配位数是12,或由乙图可知,与顶点最近的原子在面心,则配位数为
| 3×8 |
| 2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| M |
| V |
| ||
(2
|
| 4M | ||
NA(2
|
| 4M | ||
NA(2
|
Ⅱ.原子序数小于36的元素A和B,在周期表中既处于同一周期又位于同一族,则A、B只能处于第VⅢ族,原子序数B比A多1,基态B原子中含有三个未成对电子,则B是Co元素,B是第四周期第VIII族;A是Fe元素,铁失去4s能级上2个电子,导致d能级上的电子为其价电子,所以亚铁离子的价电子排布式为3d6,占据的能层符号3d;
故答案为:第四周期Ⅷ族;3d;3d6.
点评:本题考查较综合,涉及晶胞计算、配合物成键、杂化、电子排布等,综合性较强,侧重物质结构与性质的考查,注重分析能力、计算能力、综合应用能力的训练,题目难度中等.

练习册系列答案
相关题目
下列物质中属于电解质的是( )
| A、盐酸 | B、蔗糖 | C、铜 | D、NaCl |
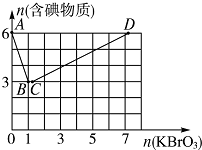 现向含6molKI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.请回答下列问题:
现向含6molKI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.请回答下列问题: