��Ŀ����
1����ϩ��һ����Ҫ�Ļ���ԭ�ϣ�����ϩΪԭ���������ֻ�����Ʒ�ķ�Ӧ��ͼ�����ַ�Ӧ��������ȥ����
��ش��������⣺
��1��A���������Ҵ������еĹ������������ǻ���ʵ������Aת��Ϊ��ϩ�ķ�Ӧ����ΪŨ���ᡢ170�森
��2��B��A��Ӧ����C�Ļ�ѧ����ʽΪCH3CH2OH+CH3COOH$?_{��}^{Ũ����}$CH3COOCH2CH3+H2O���÷�Ӧ������Ϊ������Ӧ��ȡ����Ӧ��
��3��F�Ľṹ��ʽΪ
 ��
����4��д��D��ͬ���칹��Ľṹ��ʽCH3CHO��
��5����ȲҲ�dz�����һ�ֻ���ԭ�ϣ���������ȡ�ܶ����Ʒ�����磺������ϩ���ϣ�д������Ȳ�ϳɾ�����ϩ�ĺϳ�·�ߣ����ϳ�·�߳��õı�ʾ��ʽΪ��A$��_{��Ӧ����}^{��Ӧ�Լ�}$B��$��_{��Ӧ����}^{��Ӧ�Լ�}$Ŀ����
���� ��ϩ��ˮ�ӳ������Ҵ�A��AΪC2H5OH���Ҵ�����������B�����B�ķ���ʽ��֪BΪCH3COOH���������Ҵ���Ӧ����C��CΪCH3COOC2H5����ϩ��������Ӧ����DΪ�������� ����Ϊ����������Ҫ�����ᷢ��������Ӧ��1��2��Ӧ��D��E�ǿ����ӳɷ�Ӧ����EΪ�Ҷ������Ҷ��������ᷴӦ����F��C6H10O4����FΪ�������Ҷ�����
����Ϊ����������Ҫ�����ᷢ��������Ӧ��1��2��Ӧ��D��E�ǿ����ӳɷ�Ӧ����EΪ�Ҷ������Ҷ��������ᷴӦ����F��C6H10O4����FΪ�������Ҷ����� �����Դ˽����⣮
�����Դ˽����⣮
��� �⣺��1�������Ϸ�����֪AΪ�Ҵ��������ǻ�������Ũ���������¼��ȵ�170�淢����ȥ��Ӧ������ϩ���ʴ�Ϊ���Ҵ����ǻ���Ũ���ᡢ170�棻
��2��B��A��Ӧ���������Ҵ���Ӧ����������������Ӧ����ʽΪ��CH3CH2OH+CH3COOH$?_{��}^{Ũ����}$CH3COOCH2CH3+H2O���÷�Ӧ������Ϊ������Ӧ��
�ʴ�Ϊ��CH3CH2OH+CH3COOH$?_{��}^{Ũ����}$CH3COOCH2CH3+H2O��������Ӧ��ȡ����Ӧ��
��3�������Ϸ�����֪FΪ�������Ҷ������ṹ��ʽΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��4��DΪ�������� ��ͬ���칹��ΪCH3CHO���ʴ�Ϊ��CH3CHO��
��ͬ���칹��ΪCH3CHO���ʴ�Ϊ��CH3CHO��
��5������Ȳ�ϳɾ�����ϩ��������HCl�����ӳɷ�Ӧ��������ϩ������ϩ�����Ӿ۷�Ӧ�����ɾ�����ϩ������ΪCH��CH$��_{����������}^{HCl}$CH2=CHCl$��_{���¸�ѹ}^{����}$ ���ʴ�Ϊ��CH��CH$��_{����������}^{HCl}$CH2=CHCl$��_{���¸�ѹ}^{����}$
���ʴ�Ϊ��CH��CH$��_{����������}^{HCl}$CH2=CHCl$��_{���¸�ѹ}^{����}$ ��
��
���� ���⿼���л��ƶϣ��漰ϩ�������ᡢ�������ʣ��Ƕ��л�������֪ʶ���ۺϿ��飬�ܽϺõĿ��鿼����˼ά�������ѶȲ����Ǹ߿��ȵ����ͣ�

| A�� | 3��4-�������� | B�� | 2��3-�������� | ||
| C�� | ���� | D�� | 2��2��3��3-�ļ����� |

��֪����Cu2O+2H+=Cu+Cu2++H2O
�ڼ����������↑ʼ��������ȫ������pH�����
| �������� | Al��OH��3 | Fe��OH��2 | Fe��OH��3 | Cu��OH��2 |
| ��ʼ������pH | 4.0 | 5.8 | 1.1 | 5.4 |
| ��ȫ������pH | 5.2 | 8.8 | 3.2 | 6.7 |
��1������A ��Ҫ������������ɣ��仯ѧʽΪSiO2��Cu��
��2����������˺���Һ����Ԫ�صĴ�����ʽΪFe2+�������ӷ��ţ������ɸ����ӵ����ӷ���ʽΪ2Fe3++Cu=2Fe2++Cu2+��
��3������B�Ļ�ѧʽΪFe��OH��3�����������з�����Ӧ�����ӷ���ʽΪ2Fe2++ClO-+2CO32-+3H2O=Fe��OH��3��+Cl-+2CO2����
��4����NaOH������ҺpH�ķ�Χ��5.2��pH��5.4����ҵ�϶Գ���B������C������Ӧ��ȡ�Ĵ��������Ǽ��ȷֽ�õ���Ӧ�����������ұ����������
| t�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK=$\frac{c��CO��c��{H}_{2}O��}{c��C{O}_{2}��c��{H}_{2}��}$��
��2����Ӧ�����ȷ�Ӧ�����жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬��������bc��
a��������ѹǿ����
b�����������c��CO������
c��v����H2��=v����H2O��
d��c��CO2��=c��CO��
��3��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO2��c��CH2��=c��CO��c��H2O�������жϴ�ʱ���¶�Ϊ830��



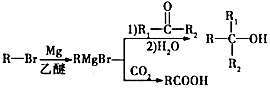
 ���䷴Ӧ����Ϊȡ����Ӧ��
���䷴Ӧ����Ϊȡ����Ӧ�� ��
�� ��д�ṹ��ʽ����
��д�ṹ��ʽ����
 ��
�� ����Fe�������Ͳ��ϣ����г�ǿ���ԡ���Ч���ԣ�ij��ѧС��̽����������̼��������ȡ�������ۣ���ʵ�������ͼ�����ȡ�֧��װ��ʡ�ԣ�
����Fe�������Ͳ��ϣ����г�ǿ���ԡ���Ч���ԣ�ij��ѧС��̽����������̼��������ȡ�������ۣ���ʵ�������ͼ�����ȡ�֧��װ��ʡ�ԣ�