题目内容
2.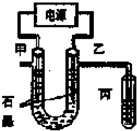 CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu(H2O)42+(蓝色)+4Cl-?CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电.下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝.回答下列问题:
CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu(H2O)42+(蓝色)+4Cl-?CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电.下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝.回答下列问题:(1)甲电极的电极反应式为Cu2++2e-=Cu.
(2)丙中溶液变蓝是乙电极产物与KI反应导致的,该反应的化学方程式为Cl2+2KI=2KCl+I2.
(3)随电解的不断进行,U型管中溶液的颜色变化为A;
A.由黄色变为浅蓝色 B.由蓝色变为浅黄色
(4)当电解到一定程度,甲电极附近出现蓝色Cu(OH)2絮状物.经测,甲电极附近溶液的pH=a,此时甲电极附近溶液中c(Cu2+)=2.2×10(8-2a) mol•L-1.(已知:Cu(OH)2的Ksp=2.2×10-20).(${K_{sp}}=c(C{u^{2+}})•{c^2}{(OH)^-}=2.2×{10^{-20}}$)
分析 (1)实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝,说明丙中生成碘,应被氯气氧化生成,则乙为阳极,生成氯气,甲为阴极,发生还原反应生成铜;
(2)丙中的KI-淀粉溶液慢慢变蓝,说明丙中生成碘,应是碘离子被氯气氧化生成;
(3)随着电解的进行,溶液中Cl-不断消耗,CuCl42-转化为Cu(H2O)42+,由Cu(H2O)42+(蓝色)+4Cl-?CuCl42-(黄色)+4H2O可知,溶液应逐渐变为蓝色;
(4)结合溶度积Ksp=c2(OH-)×c(Cu2+),计算溶液浓度.结合题给信息书写相关反应的离子方程式.
解答 解:实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝,说明丙中生成碘,应被氯气氧化生成,则乙为阳极,甲为阴极,
(1)甲为阴极,发生还原反应生成铜,电极方程式为Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(2)丙中溶液变蓝是乙电极产物氯气与KI反应导致的,反应的方程式为Cl2+2KI=2KCl+I2,
故答案为:Cl2+2KI=2KCl+I2;
(3)随着电解的进行,溶液中Cl-不断消耗,CuCl42-转化为Cu(H2O)42+,由Cu(H2O)42+(蓝色)+4Cl-?CuCl42-(黄色)+4H2O可知,溶液应逐渐变为蓝色,
故答案为:A;
(4)Ksp=c2(OH-)×c(Cu2+),c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1{0}^{a-14})^{2}}$=2.2×10(8-2a)(mol/L)
故答案为:2.2×10(8-2a).
点评 本题考查综合考查电化学知识,侧重于电解的原理和考查与应用,为高考常见题型和高频考点,注意把握电极方程式的书写,难度不大.

练习册系列答案
相关题目
20.图是元素周期表的一部分,下列说法正确的是( )
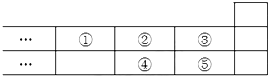

| A. | 元素①位于第二周期第IVA族 | |
| B. | 元素的最高正价是③=⑤ | |
| C. | 最高价氧化物对应水化物的酸性:③>⑤>④ | |
| D. | 气态氢化物的稳定性:④<②<③ |
10.将煤粉隔绝空气加强热,除主要得到焦炭外,还能得到如表所列的物质:
(1)表中所列物质不属于有机物的是(填序号):②⑦.
(2)能与溴水反应使之褪色的烃是(填序号):③.
(3)能发生加聚反应、生成物可用作制造食品包装袋的是(填序号)③,该物质发生加聚反应的化学方程式为:nCH2=CH2$\stackrel{催化剂}{→}$ .
.
(4)彼此互为同系物的是(填序号):④⑤.
(5)甲苯的一氯取代产物的有4种.
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 名称 | 甲烷 | 一氧化碳 | 乙烯 | 苯 | 甲苯 | 苯酚 | 氨水 |
(2)能与溴水反应使之褪色的烃是(填序号):③.
(3)能发生加聚反应、生成物可用作制造食品包装袋的是(填序号)③,该物质发生加聚反应的化学方程式为:nCH2=CH2$\stackrel{催化剂}{→}$
 .
.(4)彼此互为同系物的是(填序号):④⑤.
(5)甲苯的一氯取代产物的有4种.
7.用石墨电极电解1molL -1的下列溶液,溶液的pH不变的是( )
| A. | HCl | B. | NaOH | C. | Na 2SO 4 | D. | NaCl |
14.将含有0.400mol Cu(NO3)2和0.400mol KCl的一定体积的水溶液,用惰性电极电解一段时间后,在一个电极上析出19.2g Cu,此时在另一电极上放出的气体在标准状况下的体积为( )
| A. | 3.36 L | B. | 6.72 L | ||
| C. | 大于3.36 L,小于5.60 L | D. | 大于5.60 L,小于6.72 L |
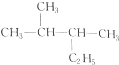 与
与
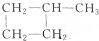 与
与
 与
与
 和
和
 和
和
 ,A2C2的结构式:H-O-O-H.
,A2C2的结构式:H-O-O-H.