题目内容
4.设NA为阿伏加德罗常数的值.下列说法不正确的是( )| A. | 25℃时,100mL pH=13的Ba(OH)2溶液中含有的OH-数为0.01NA | |
| B. | T℃时,2L 0.25mol•L-1NH4Cl溶液与1L0.50mol•L-1NH4Cl溶液含NH${\;}_{4}^{+}$的个数不同 | |
| C. | 1L 1mol•L-1的CH3COONa溶液中CH3COOH和CH3COO-的总数为NA | |
| D. | Fe在少量Cl2中燃烧生成0.5mol产物,转移的电子数为NA |
分析 A、pH=13的氢氧化钡溶液中,氢氧根的浓度为0.1mol/L;
B、溶液越稀,盐的水解程度越大;
C、根据物料守恒来分析;
D、铁在氯气中燃烧变为+3价.
解答 解:A、pH=13的氢氧化钡溶液中,氢氧根的浓度为0.1mol/L,故100mL溶液中含有的氢氧根的物质的量为n=CV=0.1mol/L×0.1L=0.01mol,个数为0.01NA个,故A正确;
B、溶液越稀,盐的水解程度越大,而2L 0.25mol•L-1NH4Cl溶液相当于是将1L0.50mol•L-1NH4Cl溶液稀释所得到的,故2L 0.25mol•L-1NH4Cl溶液中铵根离子的水解程度大于1L0.50mol•L-1NH4Cl溶液中的水解程度,故两溶液中的铵根离子的个数不同,故B正确;
C、1L 1mol•L-1的CH3COONa溶液中CH3COONa的物质的量为1mol,而CH3COO-是弱酸根,在溶液中部分水解为CH3COOH,故溶液中的CH3COOH和CH3COO-的总数为NA,故C正确;
D、铁在氯气中燃烧变为+3价,故当生成0.5mol产物时,即消耗0.5mol铁,则转移1.5NA个电子,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
15.下列溶液中,能用来检验苯酚的是( )
| A. | 氢氧化钠 | B. | 浓硫酸 | C. | 三氯化铁 | D. | 石蕊溶液 |
12.检验硫酸钠溶液中含有氯离子的方法是( )
| A. | 先加BaCl2溶液过滤,再加AgNO3溶液 | |
| B. | 先加AgNO3溶液,再加稀硝酸溶液 | |
| C. | 先加足量的Ba(NO3)2溶液,过滤,再加AgNO3溶液 | |
| D. | 先加足量的BaCl2溶液,过滤,再加AgNO3溶液 |
9.14.2g质量分数为69%的浓硝酸(密度为1.420g•cm-3)与10mL15.55mol•L-1的硝酸的浓度相比( )
| A. | 是同一浓度的不同表示方法 | B. | 数值不同,但也能换算为相同值 | ||
| C. | 是不同浓度的两种硝酸 | D. | 无法比较其大小 |
16.下列各组离子反应可以用H++OH-═H2O表示的有( )
| A. | Cu(OH)2和HNO3 | B. | Ba(OH)2与H2SO4 | C. | CO2和NaOH溶液 | D. | H2SO4和NaOH |
17.某元素的最高价氧化物对应的水化物的分子式是H4RO4,则其氢化物的分子式是( )
| A. | RH3 | B. | H2R | C. | RH4 | D. | HR |
18.下列离子方程式中,不正确的是( )
| A. | 溴化钾溶液跟适量氯水反应 Cl2+2Br-═Br2+2Cl- | |
| B. | 碳酸钠溶液跟足量盐酸反应 CO32-+2H+═H2O+CO2↑ | |
| C. | 将铁粉放入稀盐酸中 Fe+2H+═Fe2++H2↑ | |
| D. | 将金属钠放入水中 Na+2H2O═Na++2OH-+H2↑ |

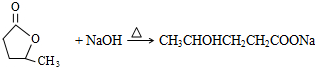 .
. .
.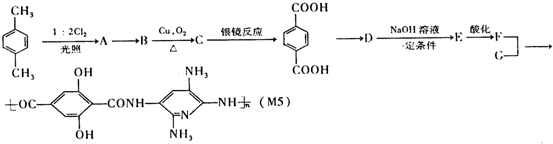
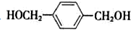 ;合成M5的单体的结构简式:F
;合成M5的单体的结构简式:F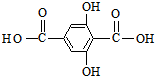 ,G
,G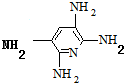 ;
;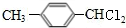 ;
;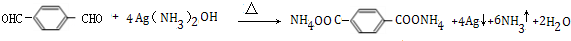 .
.