��Ŀ����
6����ˮ�����౦�����Ȼ��Դ��ͼ1��ij�����Ժ�ˮ��Դ�ۺ����õIJ�������ʾ���
��1�����оٺ�ˮ���������ַ��������������������ӽ�������
��2�����Ƶ�ʳ��ˮͨ�����ӽ���Ĥ���۵�⣮ͼ2Ϊ���ӽ���Ĥ�����ԭ��ʾ��ͼ����ⱥ��ʳ��ˮ�����ӷ���ʽΪ2Cl-+2H2O $\frac{\underline{\;ͨ��\;}}{\;}$Cl2��+H2��+2OH-���Ը��ݵ缫��Ӧ����������Ĥ������X��Na+��
��3����֪[Ca��OH��2=5.5��l0-6��Mg��OH��2=1.8��l0-11]����c��Mg2-��=3.6��l0-3mol/L �� MgCl2��Һ�� cmol/L��NaOH��Һ�������ϣ�Ҫʹ���Һ����Mg��OH��2������c���ٵ���2.0��10-4mol/L������������õ�Mg��OH��2�����г�����Ca��OH��2��������ȥ��д����ķ���������MgCl2��Һ����ֽ��裬���ˣ�����������ˮˮϴ�ӣ�
��4����ҵ��ȡþ������MgCO3�����ȷֽ⣬�ʶ����ӽ�̿�����Ȼ��õ�MgCl2�����ͨ�����MgCl2��ȡMg��д���÷��ʶ����Ļ�ѧ����ʽ2MgO+C+2Cl2�T2MgCl2+CO2����������Ȼ�þ���õ�þ������ȴ��Ϊ����þ�����������У�þ�������������Χ����ȴ����C��ѡ������ĸ����
A��Cl2B��N2C��H2D������
��5����ͬѧ��Ϊ������ۺ�ɼ���Mg��OH��2�����õ�MgO���ٵ�����ڵ�MgO�ƽ���þ�������ɼ�ʵ�鲽�裬����ʵ��ļ�Լ��ԭ���Ҳ�ͬ��Ĺ۵㣬������������ΪMgO�۵�ߣ�����ʱ���ķѴ��������������������ɱ���
���� ��ˮ�����õ����Σ��ᴿ��ȥ���ʺ��ܽ⣬�õ������Ȼ�����Һ���缫�Ȼ�����Һ������������ĸҺ�м��뱴�����յõ�������������ˮ�����������ƣ�����ĸҺ�г���þ��������������þ���������˵õ��������������ܽ�Ũ���õ��ᾧˮ������Ȼ�����������ˮ�õ������Ȼ�þ���缫�����Ȼ�þ�õ�þ��
��1��Ŀǰ������ˮ�ķ����ж��֣��磺����������������ˮ������ܼ���ȡ���ͱ�������
��2����⾫�Ʊ���ʳ��ˮ�����������������ռ����������������������������������������
��3����c��Mg2-��=3.6��l0-3mol/L �� MgCl2��Һ�� cmol/L��NaOH��Һ�������ϣ�Ҫʹ���Һ����Mg��OH��2��������Ҫ����������Ũ�����ܶȻ���������õ���
��4���ʶ����ӽ�̿�����Ȼ��õ�MgCl2��̼������������þ��Ӧ�����Ȼ�þ�Ͷ�����̼��þ�������������Χ����ȴ�������岻��þ������Ӧ��
��5������þ���Ȼ�þ���۵㲻ͬ������þ�۵�߲������ڽ��
��� �⣺��1����ˮ�����ķ����У������������������ӽ������ȣ�
�ʴ�Ϊ�������������������ӽ������ȣ�
��2����⾫�Ʊ���ʳ��ˮ�ķ�����ȡ�������������ռ��Ӧ�����ӷ���ʽΪ��2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2OH-+H2��+Cl2����X��������������˵��XΪ�����ӣ���ҪΪNa+��
�ʴ�Ϊ��2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2OH-+H2��+Cl2����Na+��
��3��Ksp��Mg��OH��2 ��=1.8��l0-11 ����c��Mg2-��=3.6��l0-3mol/L �� MgCl2��Һ�� cmol/L��NaOH��Һ�������ϣ�c��Mg2-��=1.8��l0-3mol/L�����ɳ���ʱ�����Һ������������Ũ��=$\sqrt{\frac{Ksp}{c��M{g}^{2+}��}}$=$\sqrt{\frac{1.8��1{0}^{-11}}{1.8��1{0}^{-3}}}$=10-4mol/L��ԭ����������Һ��c=2.0��10-4mol/L���ܶȻ���������������ܶȻ�����С������ת�����������Ƶ��ܶȻ���������������þ�����Լ����Ȼ�þ��Һ����ֽ��裬���ˣ�������ˮϴ�ӵõ�������þ���壬�ʴ�Ϊ�������Ȼ�þ��Һ����ֽ��裬���ˣ�������ˮϴ�ӣ�
�ʴ�Ϊ��2.0��10-4������ MgCl2 ��Һ����ֽ��裬���ˣ�����������ˮˮϴ�ӣ�
��4����ҵ��ȡþ������MgCO3�����ȷֽ⣬�ʶ����ӽ�̿�����Ȼ��õ�MgCl2�����ͨ�����MgCl2��ȡMg���÷��ʶ����Ļ�ѧ����ʽΪ��2MgO+C+2Cl2�T2MgCl2+CO2����������Ȼ�þ���õ�þ������ȴ��Ϊ����þ�����������У�þ�������������Χ����ȴ���Dz��ܺ�þ������Ӧ��
A��Cl2��þ��Ӧ�������������A����
B��N2��þ������Ӧ���ɵ���þ��������ȴ����B����
C��H2��þ���ܷ�Ӧ��������ȴ����C��ȷ��
D��������þ������Ӧ������������ȴ����D����
�ʴ�Ϊ��2MgO+C+2Cl2�T2MgCl2+CO2��C��
��5��MgO�۵�Ϊ3105�棬MgCl2�۵�714�棬����MgOʱ�ķѴ����������������������ɱ���
�ʴ�Ϊ����Ϊ MgO �۵�ߣ�����ʱ���ķѴ��������������������ɱ���
���� ���⿼���˴Ӻ�ˮ����ȡþ�ķ�Ӧԭ���������ܽ�ƽ����ܶȻ��������㡢�������ʵȣ�������ѧ֪ʶ�������ͼ��Ϣ�ǽ����Ĺؼ�����Ŀ�Ѷ��еȣ�

| A�� |  ͼ���Ա�ʾSi��P��S��Cl����Ԫ�ص�������ϼ۵ľ���ֵ | |
| B�� | 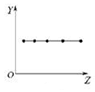 ͼ���Ա�ʾ��A��Ԫ�ص�ԭ������������ | |
| C�� |  ͼ���Ա�ʾ��A��Ԫ����̬�⻯����ȶ��� | |
| D�� | 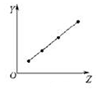 ͼ���Ա�ʾ�������ڷǽ���Ԫ�ص�����������Ӧˮ��������� |

| A�� | ����һ�ȴ�����6�� | |
| B�� | ���ķ��������е�̼ԭ��һ����ͬһƽ���� | |
| C�� | ���Ͷ������� ����Ϊͬ���칹�� ����Ϊͬ���칹�� | |
| D�� | һ�������£����ֱ���Է����ӳɡ�ȡ������������ԭ�ȷ�Ӧ |
�ټ��ȡ�
�ڲ���ϡ���ᣬ����98%��Ũ���ᡡ
������ͬŨ��ϡ�����������
�ܲ�����Ƭ���������ۡ�
�ݵμӼ���CuSO4��Һ��
| A�� | �٢ڢۢܢ� | B�� | �٢ۢ� | C�� | �ڢ� | D�� | �ۢ� |
�����뾶��S2-��Cl-��F
���⻯����ȶ��ԣ�HF��HCl��H2S��H2Te
�����ӵĻ�ԭ�ԣ�S2-��Cl-��Br-��I-
�������ԣ�Cl2��S��Se��Te
�����ԣ�H2SO4��HClO4��H2SeO4
�ǽ����ԣ�F��Cl��S��Se
�ߵ�����ˮ��Ӧ�ľ��ҳ̶ȣ�F2��Cl2��Br2��I2��
| A�� | �٢ڢܢ� | B�� | �٢ۢ� | C�� | �٢� | D�� | �ݢ� |
N2+3H2$?_{���¡���ѹ}^{����}$2NH3
��v��N2��=0.2mol/��L•min��
��v��NH3��=0.9mol/��L•min��
��v��H2��=0.45mol/��L•min��
��v��H2��=0.01mol/L•s��
| A�� | �٢� | B�� | �٢� | C�� | �ۢ� | D�� | �ڢ� |
| I1 | I2 | I3 | I4 | I5 | I6 | |
| I/kJ��mol-1 | 578 | 1817 | 2745 | 11578 | 14831 | 18378 |
| A�� | +1 | B�� | +2 | C�� | +3 | D�� | +6 |
 �����£���100mL0.01mol•L-1HA��Һ����μ���0.02mol•L-1MOH��Һ��ͼ����ʾ���߱�ʾ�����Һ��pH�仯�������Һ����仯���Բ��ƣ�������˵������ȷ���ǣ�������
�����£���100mL0.01mol•L-1HA��Һ����μ���0.02mol•L-1MOH��Һ��ͼ����ʾ���߱�ʾ�����Һ��pH�仯�������Һ����仯���Բ��ƣ�������˵������ȷ���ǣ�������| A�� | MOHΪһԪǿ��HAΪһԪǿ�� | |
| B�� | K ���Ӧ����Һ�У�c��M+��+c��MOH��=c��A-�� | |
| C�� | K���Ӧ����Һ�У�c��MOH��+c��OH-��-c��H+��=0.005mol•L-1 | |
| D�� | N��ˮ�ĵ���̶�С��K��ˮ�ĵ���̶� |