题目内容
4.某碳酸钠溶液中的钠离子与水分子的个数比是1:20,则该溶液的质量分数为( )| A. | 6.4% | B. | 25.6% | C. | 12.8% | D. | 60% |
分析 根据溶质质量分数=$\frac{溶质质量}{溶液质量}$100%,结合题意进行分析解答.
解答 解:碳酸钠溶液中含有钠离子、碳酸根离子和水分子,碳酸钠的化学式为Na2CO3,钠离子与碳酸根离子之比是2:1,某碳酸钠溶液中Na+与水分子的个数比为1:20,则溶液中碳酸钠与水分子的粒子个数比为1:40,碳酸钠的相对分子质量为106,溶液中溶质的质量分数为$\frac{106}{106+18×40}$×100%≈12.8%.
故选C.
点评 本题考查了溶液的质量分数的计算,题目难度不大,侧重于考查学生的分析能力和计算能力,注意根据碳酸钠与水分子数目之间的关系计算.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
12.下列说法中正确的是( )
| A. | 向0.1 mol•L-1氨水中加入少量水,pH减小,c(OH-)/c(NH3•H2O)减小 | |
| B. | 保存FeSO4溶液时,加入稀HNO3抑制Fe2+水解 | |
| C. | FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体 | |
| D. | 将纯水加热的过程中,Kw变大,pH变小 |
19.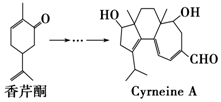 CyrneineA对治疗神经系统疾病有着很好的疗效,制备CyrneineA可用香芹酮经过多步反应合成:下列说法不正确的是( )
CyrneineA对治疗神经系统疾病有着很好的疗效,制备CyrneineA可用香芹酮经过多步反应合成:下列说法不正确的是( )
 CyrneineA对治疗神经系统疾病有着很好的疗效,制备CyrneineA可用香芹酮经过多步反应合成:下列说法不正确的是( )
CyrneineA对治疗神经系统疾病有着很好的疗效,制备CyrneineA可用香芹酮经过多步反应合成:下列说法不正确的是( )| A. | 香芹酮化学式为C10H14O | |
| B. | CyrneineA可以发生加成反应、消去反应和氧化反应 | |
| C. | 香芹酮和CyrneineA均能使酸性KMnO4溶液褪色 | |
| D. | 与香芹酮互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有4种 |
13.下列物质互为同分异构体的是( )
| A. | ${\;}_{1}^{1}$H2O和${\;}_{1}^{2}$H2O | B. | 乙烯和丙烯(CH2═CHCH3) | ||
| C. | 石墨和C60 | D. | CH3CHCH3CH3和CH3CH2CH2CH3 |




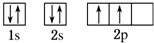 ,B原子的核外电子排布式1s22s22p63s23p2,C原子的价电子排布式3s23p5.
,B原子的核外电子排布式1s22s22p63s23p2,C原子的价电子排布式3s23p5.