题目内容
有关常温下pH均为3的醋酸溶液和盐酸的说法正确的是( )
| A、两种溶液中,由水电离出的氢离子浓度均为l×10-11 mol?L-1 |
| B、分别加水稀释100倍后,两种溶液的pH仍相等 |
| C、中和同体积的这两种酸溶液所需要NaOH物质的量也相等 |
| D、分别加入足量锌片,两种溶液生成H2的体积相等 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:醋酸是弱电解质,HCl是强电解质,所以pH相等的醋酸和盐酸,c(CH3COOH)>c(HCl),
A.酸溶液中由水电离出的c(H+)等于溶液中c(OH-);
B.加水稀释促进弱电解质醋酸电离;
C.中和等体积等pH的醋酸和盐酸,需要的n(NaOH)与酸的物质的量成正比;
D.分别加入足量的锌片,生成氢气体积与酸的物质的量成正比.
A.酸溶液中由水电离出的c(H+)等于溶液中c(OH-);
B.加水稀释促进弱电解质醋酸电离;
C.中和等体积等pH的醋酸和盐酸,需要的n(NaOH)与酸的物质的量成正比;
D.分别加入足量的锌片,生成氢气体积与酸的物质的量成正比.
解答:
解:醋酸是弱电解质,HCl是强电解质,所以pH相等的醋酸和盐酸,c(CH3COOH)>c(HCl),
A.酸溶液中由水电离出的c(H+)等于溶液中c(OH-)=
=
mol/L=l×10-11 mol?L-1,水的离子积常数和溶液的pH相等,所以由水电离出的氢离子浓度相等,故A正确;
B.加水稀释促进弱电解质醋酸电离,所以醋酸继续电离出氢离子,而HCl不再电离出氢离子,导致稀释后醋酸中氢离子浓度大于盐酸,所以醋酸pH小于HCl,故B错误;
C.中和等体积等pH的醋酸和盐酸,需要的n(NaOH)与酸的物质的量成正比,体积、pH相等的醋酸和盐酸,醋酸的物质的量大于盐酸,所以醋酸消耗NaOH多,故C错误;
D.分别加入足量的锌片,生成氢气体积与酸的物质的量成正比,pH、体积相等的醋酸和盐酸,醋酸的物质的量大于盐酸,所以醋酸生成氢气多,故D错误;
故选A.
A.酸溶液中由水电离出的c(H+)等于溶液中c(OH-)=
| Kw |
| 10-pH |
| 10-14 |
| 10-3 |
B.加水稀释促进弱电解质醋酸电离,所以醋酸继续电离出氢离子,而HCl不再电离出氢离子,导致稀释后醋酸中氢离子浓度大于盐酸,所以醋酸pH小于HCl,故B错误;
C.中和等体积等pH的醋酸和盐酸,需要的n(NaOH)与酸的物质的量成正比,体积、pH相等的醋酸和盐酸,醋酸的物质的量大于盐酸,所以醋酸消耗NaOH多,故C错误;
D.分别加入足量的锌片,生成氢气体积与酸的物质的量成正比,pH、体积相等的醋酸和盐酸,醋酸的物质的量大于盐酸,所以醋酸生成氢气多,故D错误;
故选A.
点评:本题考查弱电解质电离,明确弱电解质电离特点是解本题关键,知道C中消耗氢氧化钠的物质的量、D中生成氢气的量与酸的物质的量有关,与电解质强弱无关,为易错点,易错选项是A.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
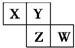 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍.下列说法正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍.下列说法正确的是( )| A、元素Y和元素Z的氢化物中均只存在极性共价键 |
| B、单核阴离子半径的大小顺序为:r(W)>r(Y)>r(Z) |
| C、元素W的最高价氧化物对应水化物的酸性最强 |
| D、元素Y和元素Z的最高正化合价相同 |
随着科学技术的不断进步,制备、研究物质的手段和途径越来越先进,H3、O4、C60、N
等相继被发现.下列有关说法中,正确的是( )
+ 5 |
| A、H2与H3互为同位素 | ||
B、N
| ||
| C、C60的硬度比金刚石大 | ||
| D、O2与O4互为同素异形体 |
下列叙述中指定粒子的数目大于6.02×1023的是( )
A、2g重水(D2O,D为
| ||
| B、0.1mol F-中含有的电子数 | ||
| C、标准状况下11.2L N2和NO混合气体中的原子数 | ||
| D、1L 1mol/L Na2SO4溶液中Na+数 |
用NA表示阿伏加德罗常数,下列叙述不正确的是( )
| A、1 mol CO2 的体积为22.4L |
| B、CO2的摩尔质量为44g |
| C、64g SO2含有氧原子数2NA |
| D、NA个CO2的质量(g)与CO2的相对分子质量数值相同 |
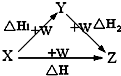 X、Y、Z、W有如图所示的转化关系,已知焓变:△H=△H1+△H2,则X、Y可能是( )
X、Y、Z、W有如图所示的转化关系,已知焓变:△H=△H1+△H2,则X、Y可能是( )①C、CO
②Na2CO3、NaHCO3
③AlCl3、Al(OH)3
④FeCl2、FeCl3.
| A、①②③④ | B、①③ |
| C、②④ | D、①②③ |
苯的一个氢原子被式量为57的烃基所取代,所得的一元取代物中能使酸性高锰酸钾褪色的有( )
| A、4种 | B、3种 | C、2种 | D、1种 |
下列有关能量转换的说法正确的是( )
| A、化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 |
| B、煤燃烧是热能转化为化学能的过程 |
| C、动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 |
| D、植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程 |
20℃的纯水的pH和80℃的纯水的pH相比较( )
| A、前者大 | B、后者大 |
| C、相等 | D、无法判断 |