题目内容
11. 金属钛冶炼过程中得到MgCl2,将熔融态MgCl2电解可得到金属镁和Cl2,氯气可制得漂白液、“84消毒液”等生活用品,试回答下列问题:
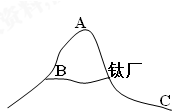
金属钛冶炼过程中得到MgCl2,将熔融态MgCl2电解可得到金属镁和Cl2,氯气可制得漂白液、“84消毒液”等生活用品,试回答下列问题:(1)如图所示,若钛厂Cl2泄露,工人应立即向A疏散(填A、B或C);
(2)漂白液暴露在空气中会逐渐失效,请用相关的化学程式解释2NaClO+H2O+CO2=Na2CO3+2HClO;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑
(3)“84消毒液”(主要成分是NaClO和NaCl)和洁厕灵(主要成分为盐酸)混用会产生有毒气体,试写出反应的离子方程式ClO-+Cl-+2H+=Cl2↑+H2O
(4)上述反应说明漂白液与酸性溶液混合会产生Cl2(全部溶于水,不会逸出),若取10ml漂白液与足量BaCl2溶液混合后,不断通入SO2至过量,在实验过程中可能观察到的现象是开始溶液变成黄绿色,后来黄绿色褪去,生成白色沉淀
(5)二氧化氯(ClO₂)是一种黄绿色到橙黄色的气体,是国际上公认为安全、无毒的绿色消毒剂,代替了Cl2用于自来水消毒.已知ClO2和Cl2的消毒能力都主要体现在氧化性,反应生成Cl-,则等物质的量的ClO2消毒能力约是Cl2的2.5倍.
分析 (1)氯气的密度比空气密度大,则下方氯气含量大;
(2)漂白液与空气中水、二氧化碳反应,HClO光照分解;
(3)二者发生氧化还原反应生成氯气;
(4)酸性时先生成氯气,然后氯气、二氧化硫反应生成硫酸根离子,最后得到硫酸钡沉淀;
(5)设物质的量均为1mol,结合化合价变化计算.
解答 解:(1)氯气的密度比空气密度大,则下方氯气含量大,则若钛厂Cl2泄露,工人应立即向A疏散,故答案为:A;
(2)漂白液与空气中水、二氧化碳反应,HClO光照分解,则发生的反应为2NaClO+H2O+CO2=Na2CO3+2HClO、2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,
故答案为:2NaClO+H2O+CO2=Na2CO3+2HClO;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑;
(3)二者发生氧化还原反应生成氯气,离子反应为ClO-+Cl-+2H+=Cl2↑+H2O,故答案为:ClO-+Cl-+2H+=Cl2↑+H2O;
(4)酸性时先生成氯气,然后氯气、二氧化硫反应生成硫酸根离子,最后得到硫酸钡沉淀,则观察到的现象为开始溶液变成黄绿色,后来黄绿色褪去,生成白色沉淀,
故答案为:开始溶液变成黄绿色,后来黄绿色褪去,生成白色沉淀;
(5)设物质的量均为1mol,ClO2消毒能力约是Cl2的$\frac{1mol×[4-(-1)]}{1mol×2×[0-(-1)]}$=2.5倍,故答案为:2.5.
点评 本题考查物质的性质及氧化还原反应,为高频考点,把握发生的反应及氧化还原反应应用等为解答的关键,侧重分析与应用能力的考查,注意(5)中结合化合价变化计算,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.科学家发现了一种新元素的原子核内有161个中子,质量数为272,该元素的核电荷数为( )
| A. | 111 | B. | 161 | C. | 272 | D. | 433 |
6.下列说法正确的是( )
①离子化合物一定含离子键,也可能含极性键或非极性键
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物一定是离子化合物
⑦不同元素组成的多原子分子里一定含有极性键
⑧非极性键只存在于双原子单质分子中.
①离子化合物一定含离子键,也可能含极性键或非极性键
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物一定是离子化合物
⑦不同元素组成的多原子分子里一定含有极性键
⑧非极性键只存在于双原子单质分子中.
| A. | ①③⑤⑦ | B. | ①③⑥⑦ | C. | ②③④⑦ | D. | ②④⑥⑧ |
16.根据①~⑩元素的编号所在周期表中的位置,用相应的元素符号回答有关问题:
(1)能显+1价,还能显-1价的元素是H、Cl.
(2)单质具有半导体性质的元素是Si.
(3)其单质能和冷水剧烈反应的元素是Na、F.
(4)a元素能以正化合价与b元素形成AB型化合物,该化合物常温下为固态且难溶于水,则a元素是Mg,b元素是O.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 3 | ⑧ | ⑨ | ⑩ |
(2)单质具有半导体性质的元素是Si.
(3)其单质能和冷水剧烈反应的元素是Na、F.
(4)a元素能以正化合价与b元素形成AB型化合物,该化合物常温下为固态且难溶于水,则a元素是Mg,b元素是O.
3.将1mol乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量乙酸充分反应.下列叙述不正确的是( )
| A. | 生成的乙酸乙酯中含有18O | B. | 生成的水分子中不含18O | ||
| C. | 可能生成44g乙酸乙酯 | D. | 可能生成90g乙酸乙酯 |
20.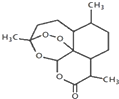 我国科学家屠呦呦获2015年诺贝尔生理学或医学奖.她研究得到的青蒿素挽救了数百万疟疾病人的生命,有关青蒿素说法合理的是( )
我国科学家屠呦呦获2015年诺贝尔生理学或医学奖.她研究得到的青蒿素挽救了数百万疟疾病人的生命,有关青蒿素说法合理的是( )
 我国科学家屠呦呦获2015年诺贝尔生理学或医学奖.她研究得到的青蒿素挽救了数百万疟疾病人的生命,有关青蒿素说法合理的是( )
我国科学家屠呦呦获2015年诺贝尔生理学或医学奖.她研究得到的青蒿素挽救了数百万疟疾病人的生命,有关青蒿素说法合理的是( )| A. | 化学式为C15H20O5 | |
| B. | 只含有氧原子一种官能团 | |
| C. | 能发生取代反应和氧化反应 | |
| D. | 可用乙醇从青蒿浸取液中萃取出青蒿素 |
1.下列化学式与指定物质的主要成分对应正确的是( )
| A. | 光导纤维--Si | B. | 熟石灰--CaO | ||
| C. | 水煤气--CO、H2 | D. | 绿矾--Fe2(SO4)3•7H2O |
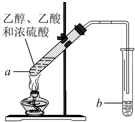 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题.