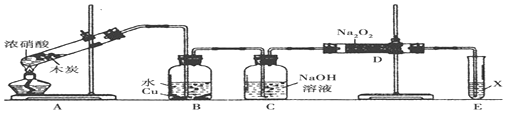
题目内容
19.下列关于萃取操作的说法正确的是( )| A. | 萃取时将萃取剂直接注入漏斗中 | |
| B. | 萃取操作完成后,静置分层,上下层液体依次从下口放出 | |
| C. | 用一种有机溶剂,提取水溶液中的某物质,静置分层,“水层”必须在上层 | |
| D. | 萃取时所选溶剂应与原溶剂互不相溶,且与溶质不反应 |
分析 A.应为分液漏斗;
B.分液操作时下层液体从下口放出,上层液体从上口倒出;
C.有机溶剂的密度可能小于水;
D.萃取时,萃取剂与溶质不反应,且不相溶,出现分层.
解答 解:A.分液时应为分液漏斗,如不是分液漏斗,则不能完成实验,故A错误;
B.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,避免两种液体相互污染,故B错误;
C.有机溶剂的密度可能小于水,也可能大于水,可能在上层或下层,故C错误;
D.萃取时,萃取剂与溶质不反应,且不相溶,出现分层,则萃取剂要和原溶剂互不相溶,且不能与溶质和溶剂反应即可,故D正确.
故选D.
点评 本题考查较为综合,涉及物质的分离、提纯以及检验等知识,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.根据元素周期表判断,下列叙述正确的是( )
| A. | L电子层的电子数为奇数的所有元素都是非金属元素 | |
| B. | 短周期元素X、Y的原子序数相差2,则X、Y不可能处于同一主族 | |
| C. | 从左至右第8、9、10三列元素中没有非金属元素 | |
| D. | 若M+和R2+的核外电子层结构相同,则可推出原子序数:R>M |
10.下列有关物质的量的说法,正确的是( )
| A. | 物质的量就是指物质的多少 | |
| B. | 原子、电子、中子、桌子等都可用物质的量来描述 | |
| C. | 物质的量是用来描述微观粒子的基本单位之一 | |
| D. | 物质的量是以摩尔为单位计量微粒数目的物理量 |
11.油漆工业的原料之一Fe2O3可由FeSO4加热分解制得,请写出该反应的化学方程式2FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO2↑+SO3↑..
8.铁、铜单质及其化合物应用范围很广.现有含氯化亚铁杂质的氯化铜晶体(CuCl2•2H2O),为制取纯净的CuCl2•2H2O,首先将其制成酸性水溶液,然后按如图步骤进行提纯:
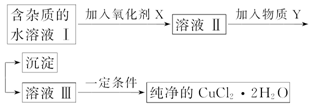
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见表:
请回答下列问题:
(1)加入氧化剂的目的是将Fe2+氧化为Fe3+,Fe3+便于生成沉淀与Cu2+分离.
(2)最适合作氧化剂X的是C,写出该反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)加入的物质Y可以是C.A.NaOH溶液 B.氨水 C.CuO D.Cu
(4)最后能不能直接蒸发结晶得到CuCl2•2H2O晶体?不能(填“能”或“不能”).若能,不用回答;若不能,回答该如何操作?应在HCl氛围中加热蒸发.

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
(1)加入氧化剂的目的是将Fe2+氧化为Fe3+,Fe3+便于生成沉淀与Cu2+分离.
(2)最适合作氧化剂X的是C,写出该反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)加入的物质Y可以是C.A.NaOH溶液 B.氨水 C.CuO D.Cu
(4)最后能不能直接蒸发结晶得到CuCl2•2H2O晶体?不能(填“能”或“不能”).若能,不用回答;若不能,回答该如何操作?应在HCl氛围中加热蒸发.
9.海水晒盐的原理是( )
| A. | 海水分解 | |
| B. | 温度升高,其他溶质的溶解度增大 | |
| C. | 升高温度,降低食盐在水中的溶解度 | |
| D. | 利用阳光、风力蒸发水分使氯化钠成晶体析出 |