题目内容
常温下,某一元酸HA和NaOH溶液等体积混合,HA和NaOH的浓度以及混合后溶液的pH如下表:
请回答下列问题:
(1)仅从甲组情况分析,c是否一定等于0.2? (选填“是”或“否”).
(2)分析乙组实验数据,HA是 酸(选填“强”或“弱”).该混合液中离子浓度由大到小的顺序是 .
(3)丙组所得混合液中由水电离出的c(OH-)= mo1?L-1.
| 组别 | c(HA)/mo1?L-1 | c(NaOH)/mo1?L-1 | 混合液pH |
| 甲 | c | 0.2 | pH=7 |
| 乙 | 0.2 | 0.1 | pH>7 |
| 丙 | 0.1 | 0.1 | pH=9 |
(1)仅从甲组情况分析,c是否一定等于0.2?
(2)分析乙组实验数据,HA是
(3)丙组所得混合液中由水电离出的c(OH-)=
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)等体积等浓度混合,恰好生成正盐,pH=9,则生成强碱弱酸盐;若酸为强酸,等体积等浓度混合时pH=7;而HA为弱酸,等体积等浓度混合溶液的pH大于7,则为保证pH=7,应使酸浓度大于0.2mol/L;
(2)由乙组实验结果可知,混合后为HA与NaA的混合液,pH>7,酸的电离小于盐的水解,并由离子的浓度比较大小写出顺序;
(3)反应后的溶液为NaA溶液,溶液的pH=9,说明NaA为强碱弱酸盐,溶液中的氢氧根离子是水电离的.
(2)由乙组实验结果可知,混合后为HA与NaA的混合液,pH>7,酸的电离小于盐的水解,并由离子的浓度比较大小写出顺序;
(3)反应后的溶液为NaA溶液,溶液的pH=9,说明NaA为强碱弱酸盐,溶液中的氢氧根离子是水电离的.
解答:
解:(1)从丙组情况分析,等体积等浓度混合,恰好生成正盐,pH=9,则生成强碱弱酸盐,所以HA为弱酸,若酸为强酸,等体积等浓度混合时pH=7;而HA为弱酸,等体积等浓度混合溶液的pH大于7,则为保证pH=7,应使酸浓度大于0.2mol/L;
故答案为:否;
(2)由乙组实验结果可知,混合后为HA与NaA的混合液,pH>7,说明A-离子水解,且酸的电离小于盐的水解,溶液显碱性,c(H+)<c(OH-),则c(Na+)>c(A-)>c(OH-)>c(H+);
故答案为:弱;c(Na+)>c(A-)>c(OH-)>c(H+);
(3)丙组实验所得溶液为NaA溶液,溶液pH=9,说明NaA为强碱弱酸盐,溶液中的氢氧根离子是水电离的,即水电离的溶液中的c(OH-)=10-5mol/L;
故答案为:10-5.
故答案为:否;
(2)由乙组实验结果可知,混合后为HA与NaA的混合液,pH>7,说明A-离子水解,且酸的电离小于盐的水解,溶液显碱性,c(H+)<c(OH-),则c(Na+)>c(A-)>c(OH-)>c(H+);
故答案为:弱;c(Na+)>c(A-)>c(OH-)>c(H+);
(3)丙组实验所得溶液为NaA溶液,溶液pH=9,说明NaA为强碱弱酸盐,溶液中的氢氧根离子是水电离的,即水电离的溶液中的c(OH-)=10-5mol/L;
故答案为:10-5.
点评:本题考查酸碱混合溶液pH的计算及离子浓度大小的比较,明确酸碱混合后溶液中的溶质、盐类水解、弱酸的浓度与pH的关系即可解答,题目难度中等.

练习册系列答案
相关题目
利用下列实验装置及药品(依次为①-④)能完成相应实验的是( )
A、 实验测定化学反应速率 |
B、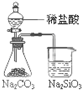 能证明非金属性 Cl>C>Si |
C、 实验制取并收集NH3 |
D、 滴定法测定盐酸浓度 |
下列各组物质中,最简式相同,但既不是同系物,又不是同分异构体的是( )
| A、乙烯和环丙烷 |
| B、CH≡C-CH3和CH2=CH-CH=CH2 |
| C、2,2-二甲基丙烷和2-甲基丁烷 |
| D、乙烯和丙烯 |
铝制器皿不易被腐蚀的原因是( )
| A、铝不易发生化学反应 |
| B、铝的氧化物难溶于酸和碱 |
| C、铝密度小 |
| D、铝器表面致密氧化膜对内部铝具有保护作用 |
如图所示,a、b是石墨电极,通电一段时间后,b极附近溶液显红色.下列说法正确的是( )

| A、X极是电源的负极,Y极是电源的正极 |
| B、Cu电极上增重6.4 g时,b极产生4.48 L(标准状况)气体 |
| C、电解过程中CuSO4溶液的pH逐渐增大 |
| D、a极的电极反应式为2Cl--2e-═Cl2↑ |
蒸干下列溶液,能得到该溶质的是( )
| A、Na2SO3溶液 |
| B、KNO3溶液 |
| C、Fe2(SO4)3溶液 |
| D、AlCl3溶液 |


