题目内容
氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(1)甲的化学式是_________;乙的电子式是__________。
(2)甲与水反应的化学方程式是__________________________________。
(3)气体丙与金属镁反应的产物是_______(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式_________。有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之______________。(已知Cu2O+2H+==Cu+Cu2++H2O)
(5)甲与乙之间_______(填“可能”或“不可能”)发生反应产生H2,判断理由是________。
(1)AlH3 
(2)AlH3+3H2O=Al(OH)3+3H2↑
(3)Mg3N2
(4)2NH3+3CuO 3Cu+ N2↑+3H2O;取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,证明产物Cu中含有Cu2O;若溶液不变蓝色,证明产物Cu中不含Cu2O。
3Cu+ N2↑+3H2O;取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,证明产物Cu中含有Cu2O;若溶液不变蓝色,证明产物Cu中不含Cu2O。
(5)可能;AlH3中含-1价H,NH3中含+1价H,可发生氧化还原反应产生H2。
解析

下列实验和结论不正确的是
| A.明矾和漂白粉均可用于自来水的杀菌、消毒 |
| B.用丁达尔实验可以将Al(OH)3胶体和NaCl溶液区分 |
| C.向KI溶液滴加氯水和CCl4振荡,静置后分层且下层显紫色,则氧化性:Cl2>I2 |
| D.Al(OH)3与稀H2SO4、NaOH溶液均能反应,说明AI(OH)3是两性氢氧化物 |
下列陈述I、II正确并且有因果关系的是( )
| 选项 | 陈述I | 陈述II |
| A | Fe2(SO4)3可以做净水剂 | Fe 3+水解成胶体可吸附水中的细小悬浮物 |
| B | 向Ba(NO3)2溶液中通入足量SO2,无明显现象 | 弱酸不能制强酸 |
| C | Cl2能使湿润的布条褪色 | Cl2具有漂白性 |
| D | 电解NaCl溶液制备金属钠 | NaCl是离子化合物 |
固体X只可能由A1、(NH4)2SO4 ,MgCl2.FeCl2, AlCl3, AgN03中的一种或几种组成,某同学对该固体进行了如下实验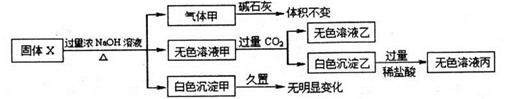
下列判断正确的是:
| A.气体甲一定是纯挣物 |
| B.白色沉淀甲可能是混合物 |
| C.固体X中一定存在AlCl3、(NH4)2SO4, MgCl2 |
| D.固体X中一定不存在FeCl2、AgNO3 |
下列说法正确的是
| A.硅和石墨都是重要的半导体材料 |
| B.SO2、NO2、CO2都会导致酸雨的形成 |
| C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理不同 |
| D.氢能是清洁能源,工业上用电解水法制大量氢气符合节能减排理念 |