题目内容
14.下列仪器中,不能加热的是( )| A. | 容量瓶 | B. | 试管 | C. | 烧瓶 | D. | 烧杯 |
分析 实验室中,能够直接加热的仪器有:试管、燃烧匙、蒸发皿和坩埚等;需要垫石棉网的是:烧杯、烧瓶、锥形瓶等;不能加热的仪器有:漏斗、量筒、集气瓶等,据此进行解答.
解答 解:A.容量瓶只能用于配制一定物质的量浓度的溶液,不能用于加热,故A选;
B.可以直接加热试管,故B不选;
C.垫上石棉网时可给烧瓶加热,故C不选;
D.垫上石棉网,可以给烧杯中溶液加热,故D不选;
故选A.
点评 本题考查常见仪器的构造及使用方法,题目难度不大,明确常见仪器的使用方法为解答关键,试题侧重基础知识的考查,有利于提高学生的分析能力及化学实验能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列说法正确的是( )
| A. | 石油的催化裂化可得到较多的轻质油 | |
| B. | “西气东输”中输送的气体主要是乙烯 | |
| C. | 煤间接液化的主要目的是获得各种芳香烃 | |
| D. | 石油通过常压分馏可以得到石蜡等相对分子质量较大的烷烃 |
2.下列关于氧的单质O2和O3的说法中,正确的是( )
| A. | O2和O3互为同位素 | B. | O2和O3的相互转化是物理变化 | ||
| C. | 等质量的O2和O3含有的原子数相同 | D. | 等体积的O2和O3含有的分子数相同 |
9.烯烃在一定条件下发生氧化反应时,碳碳双键发生断裂,RCH═CHR1可以氧化成RCHO和R1CHO.在该条件下,下列烯烃分别被氧化后,产物中可能有乙醛的是( )
| A. | CH3CH2CH=CHCH2CH3 | B. | CH2=CHCH2CH2CH3 | ||
| C. | CH3CH=CHCH2CH2CH3 | D. | CH3CH2CH=C(CH3)2 |
6.H2S在金属离子的鉴定分析、煤化工等领域都有重要应用.请回答:
Ⅰ、工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物.
(1)该反应的化学方程式为4SO2+3CH4═4H2S+3CO2+2H2O.
II.H2S可用于检测和沉淀金属阳离子.
(2)H2S的第一步电离方程式为H2S?H++HS-.
(3)己知:25℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27,该温度下,向浓度均为0.1mol•L-1的CdCl2和SnCl2的混合溶液中通人H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=8.0×10-3mol/L(溶液体积变化忽略不计).
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体.反应原理为:
ⅰ.COS(g)+H2(g)?H2S(g)+CO(g)△H=+7kJ•mol-1;
ⅱ.CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42kJ•mol-1;
(4)己知:断裂1mol分子中的化学键所需吸收的能量如下表所示.
表中x=1076.
(5)向10L容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),进行上述两个反应.其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示.

①随着温度升高,CO的平衡体积分数增大(填“增大”或“减小”),原因为反应I为吸热反应,升高温度,平衡正向移动,CO的平衡体积分数增大;反应II为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数也增大.
②T1℃时,测得平衡时体系中COS的物质的童为0.80mol.则该温度下,COS的平衡转化率为20%;反应i的平衡常数为0.044(保留两位有效数字).
Ⅰ、工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物.
(1)该反应的化学方程式为4SO2+3CH4═4H2S+3CO2+2H2O.
II.H2S可用于检测和沉淀金属阳离子.
(2)H2S的第一步电离方程式为H2S?H++HS-.
(3)己知:25℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27,该温度下,向浓度均为0.1mol•L-1的CdCl2和SnCl2的混合溶液中通人H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=8.0×10-3mol/L(溶液体积变化忽略不计).
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体.反应原理为:
ⅰ.COS(g)+H2(g)?H2S(g)+CO(g)△H=+7kJ•mol-1;
ⅱ.CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42kJ•mol-1;
(4)己知:断裂1mol分子中的化学键所需吸收的能量如下表所示.
| 分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
| 能量/kJ•mol-1 | 1319 | 442 | x | 678 | -930 | 1606 |
(5)向10L容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),进行上述两个反应.其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示.

①随着温度升高,CO的平衡体积分数增大(填“增大”或“减小”),原因为反应I为吸热反应,升高温度,平衡正向移动,CO的平衡体积分数增大;反应II为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数也增大.
②T1℃时,测得平衡时体系中COS的物质的童为0.80mol.则该温度下,COS的平衡转化率为20%;反应i的平衡常数为0.044(保留两位有效数字).
4. 合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化.为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)?2CO(g)△H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:
合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化.为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)?2CO(g)△H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:
回答下列问题:
(1)p1、p2、p3的大小关系是p1<p2<p3,欲提高C与CO2反应中CO2的平衡转化率,应采取的措施为升高温度、降低压强.图中a、b、c三点对应的平衡常数大小关系是Ka=Kb<Kc.
(2)900℃、1.013 MPa时,1 mol CO2与足量碳反应达平衡后容器的体积为V,CO2的转化率为66.7%,该反应的平衡常数K=$\frac{16}{3V}$.
(3)将(2)中平衡体系温度降至640℃,压强降至0.1013 MPa,重新达到平衡后CO2的体积分数为50%.条件改变时,正反应和逆反应速率如何变化?正反应和逆反应速率均减小,二者之间有何关系?v(正)<v(逆).
(4)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:CO(g)+3H2(g)?CH4(g)+H2O(g)△H1=-206.2kJ/mol
CO(g)+H2O(g)?CO2(g)+H2(g)△H2=-41.2kJ/mol
①则二氧化碳与氢气反应转化为甲烷和水蒸气的热化学方程式是CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-165.0kJ/mol.
②已知298 K时相关化学键键能数据为:
则根据键能计算,△H1=-198kJ/mol,它与上述实测值差异较大的原因可能是反应温度、压强不同,键能数据不准确.
 合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化.为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)?2CO(g)△H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:
合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化.为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)?2CO(g)△H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:回答下列问题:
(1)p1、p2、p3的大小关系是p1<p2<p3,欲提高C与CO2反应中CO2的平衡转化率,应采取的措施为升高温度、降低压强.图中a、b、c三点对应的平衡常数大小关系是Ka=Kb<Kc.
(2)900℃、1.013 MPa时,1 mol CO2与足量碳反应达平衡后容器的体积为V,CO2的转化率为66.7%,该反应的平衡常数K=$\frac{16}{3V}$.
(3)将(2)中平衡体系温度降至640℃,压强降至0.1013 MPa,重新达到平衡后CO2的体积分数为50%.条件改变时,正反应和逆反应速率如何变化?正反应和逆反应速率均减小,二者之间有何关系?v(正)<v(逆).
(4)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:CO(g)+3H2(g)?CH4(g)+H2O(g)△H1=-206.2kJ/mol
CO(g)+H2O(g)?CO2(g)+H2(g)△H2=-41.2kJ/mol
①则二氧化碳与氢气反应转化为甲烷和水蒸气的热化学方程式是CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-165.0kJ/mol.
②已知298 K时相关化学键键能数据为:
| 化学键 | H-H | O-H | C-H |  |
| E/(kJ•mol-1) | 436 | 465 | 413 | 1076 |

 的化学反应方程式
的化学反应方程式 、
、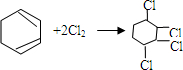 .
.
