题目内容
19.元素①~⑧在元素周期表中的位置如下,回答有关问题: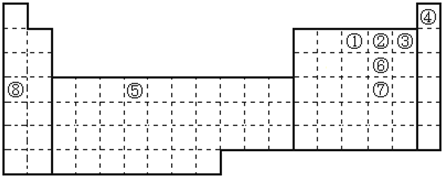
(1)写出①~⑧号元素中第一电离能最大的元素符号He.
(2)写出②⑥⑦三个元素气态氢化物的沸点顺序H2O>H2Se>H2S.(填分子式顺序)
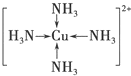
(3)请画出[Cu(NH3)4]2+离子结构示意图
 .
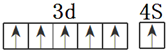
.(4)请画出⑤的外围电子排布图
 .
.(5)SeO3的空间构型为平面三角形,
(6)SeO32-离子的VSEPR构型为四面体型.
分析 由元素在周期表中的位置可知,①是N,②是O,③是F,④是He,⑤是Cr,⑥是S,⑦是Se,⑧是K,
(1)稀有气体的第一电离能最大;
(2)②⑥⑦三个元素气态氢化物中,相对分子质量大的沸点高,且水分子间含氢键,沸点最高;
(3)[Cu(NH3)4]2+离子含配位键;
(4)Cr的价电子为3d54s1;
(5)SeO3中的价层电子对=σ键个数+$\frac{1}{2}$(a-xb);
(6)中心原子S原子孤电子对数为$\frac{6+2-2×3}{2}$=1,价层电子对数=3+1=4.
解答 解:由元素在周期表中的位置可知,①是N,②是O,③是F,④是He,⑤是Cr,⑥是S,⑦是Se,⑧是K,
(1)①~⑧号元素中第一电离能最大的元素符号为He,故答案为:He;
(2)②⑥⑦三个元素气态氢化物中,相对分子质量大的沸点高,且水分子间含氢键,沸点最高,沸点为H2O>H2Se>H2S,
故答案为:H2O>H2Se>H2S;
(3)[Cu(NH3)4]2+离子结构示意图为 ,故答案为:
,故答案为: ;
;
(4)⑤的外围电子排布图为 ,故答案为:
,故答案为: ;
;
(5)SeO3中的价层电子对=3+$\frac{1}{2}$×(6-2×3)=3,该分子中含有3个价层电子对,且没有孤电子对,所以其空间构型是平面三角形,采用sp2杂化,
故答案为:平面三角形;
(6)中心原子S原子孤电子对数为$\frac{6+2-2×3}{2}$=1,价层电子对数=3+1=4,则SeO32-离子的VSEPR构型为四面体型,故答案为:四面体型.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、原子结构与性质、杂化理论等知识为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.化合物丙可由如下反应得到: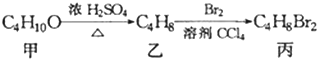 ,丙的结构简式不可能是( )
,丙的结构简式不可能是( )
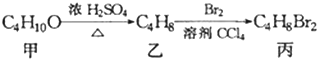 ,丙的结构简式不可能是( )
,丙的结构简式不可能是( )| A. | CH3CH(CH2Br)2 | B. | (CH3)2CBrCH2Br | C. | C2H5CHBrCH2Br | D. | CH3(CHBr)2CH3 |
10.下列递变情况不正确的是( )
| A. | Na、Mg、Al原子最外层电子数依次增多,其简单离子的氧化性依次增强 | |
| B. | P、S、Cl最高正化合价依次升高 | |
| C. | C、N、O原子半径依次增大 | |
| D. | Na、K、Rb氧化物的水化物碱性依次增强 |
7.两种气态烃组成的混合气体0.1mol,完全燃烧得0.16mol CO2和3.6g H2O,则下列关于混合气体组成的推断正确的是( )
| A. | 一定有甲烷 | B. | 一定是甲烷和乙烯 | ||
| C. | 一定没有丙炔 | D. | 一定有乙炔 |
14.短周期元素X、Y、Z,它们的原子最外层电子数依次为1、6、6,Z位于Y的上一周期,则X、Y、Z三种元素形成的某种化合物的化学式可能为( )
| A. | XY2Z3 | B. | X2YZ3 | C. | X3YZ4 | D. | X3YZ3 |
4.对下列化学反应的热现象的说法不正确的是( )
①化学反应中的能量变化都表现为热量变化
②化学反应发生过程中一定有能量变化
③吸热反应需要加热后才能发生
④化学反应吸收或放出热量的多少与参加反应的物质的多少有关.
①化学反应中的能量变化都表现为热量变化
②化学反应发生过程中一定有能量变化
③吸热反应需要加热后才能发生
④化学反应吸收或放出热量的多少与参加反应的物质的多少有关.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
11.下列递变规律正确的是( )
| A. | HClO4、H2SO4、H3PO4的酸性依次增强 | |
| B. | HCl、HBr、HI的稳定性依次增强 | |
| C. | 钠、镁、铝的还原性依次增强 | |
| D. | N、O、F原子半径逐渐减小 |
9.下列说法正确的是( )
| A. | 碘是人体必需微量元素,所以要多吃富含高碘酸的食物 | |
| B. | 实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→氧化→萃取分液 | |
| C. | 从海水中提取物质都必须通过化学反应才能实现 | |
| D. | 在“火柴头中氯元素的检验”实验中,摘下几根未燃过的火柴头,将其浸于水中,稍后取少量溶液于试管中,滴加硝酸银溶液和稀硝酸后,即可判断氯元素的存在 |
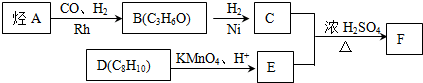

 .
. .
.