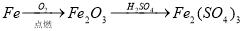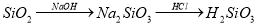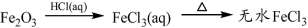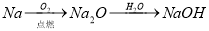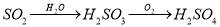题目内容
(14分)为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题.煤综合利用的一种途径如下所示:

(1)用下图所示装置定量检测过程①产生的CO2(已知:煤粉燃烧过程中会产生SO2),B中预 期的实验现象是 。

(2)已知:C(s)+H2O(g)====CO(g)+H2(g) △H1=+131.3kJ?mol-1
C(s)+2H2O(g)====CO2(g)+2H2(g) △H2=+90kJ?mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g);ΔH
CH3OCH3(g)+3H2O(g);ΔH
①该反应平衡常数表达式为K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如右图所示。该反应的ΔH________(填
“>”、“<”或“=”)0。若温度不变,减小反应投料比[n(H2) /n(CO2)],则K将________(填“增大”、“减小”或“不变”)。

(4)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。

(1)品红溶液不变色
(2)CO(g)+H2O(g)====CO2(g)+H2(g) △H=-41.3kJ?mol-1;
(3)① c(CH3OCH3)×c3(H2O)]/[c2(CO2)×c6(H2) ② < 不变
(4)Ⅲ;T1
【解析】
试题分析:(1)燃煤烟气的成分为CO2、SO2、CO、H2O,酸性高锰酸钾能够除去SO2,CO2、CO、H2O不能使品红溶液褪色,故答案为:品红溶液不变色;(2)C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ?mol-1
①C(s)+2H2O(g)=CO2(g)+2H2(g)△H2=+90kJ?mol-1 ② 由盖斯定律②-①得: CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.3kJ?mol-1(3) ①该反应平衡常数表达式为K=c(CH3OCH3)×c3(H2O)]/[c2(CO2)×c6(H2) ②由图可知,温度高CO2转化率低,平衡逆向移动,反应放热;平衡常数只与温度有关,温度不变,k不变;(4)温度越高平衡左移CO的体积分数越大,但T2时CO的体积分数小于T1时CO的体积分数,说明反应未达平衡,T3时CO的体积分数大于T2时CO的体积分数,说明Ⅲ达到平衡。而达到平衡时,根据反应放热可判断出,升高温度,平衡逆向移动,CO的体积分数减小,故CO转化率最大的反应温度是T1,
考点:煤的综合利用、盖斯定律、平衡常数的表达及影响因素、反应热的判断、化学平衡状态的判断。

一定条件下进行反应:COCl2(g) Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法正确的是
A.保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol·L-1,则反应的ΔH<0
B.若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变
C.保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,反应达到平衡前的速率:v(正)<v(逆)
D.保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60%
 2N2(g)+6H2O(g)在2L的密闭容器中进行,半分钟后N2的物质的量增加了0.6mol。此反应的平均反应速率可表示为
2N2(g)+6H2O(g)在2L的密闭容器中进行,半分钟后N2的物质的量增加了0.6mol。此反应的平均反应速率可表示为 +H+=BaSO4↓+H2O
+H+=BaSO4↓+H2O