题目内容
6.HA为酸性略强于醋酸的一元弱酸,在0.1mol•L-1NaA溶液中,离子浓度关系正确的是( )| A. | [Na+]>[A-]>[H+]>[OH-] | B. | [Na+]>[OH-]>[A-]>[H+] | C. | [Na+]+[OH-]=[A-]+[H+] | D. | [Na+]+[H+]=[A-]+[OH-] |
分析 HA为酸性略强于醋酸的一元弱酸,则NaA是强碱弱酸盐,弱酸根离子水解导致溶液呈碱性,据此分析解答.
解答 解:HA为酸性略强于醋酸的一元弱酸,则NaA是强碱弱酸盐,弱酸根离子水解导致溶液呈碱性,则[OH-]>[H+];钠离子不水解,且弱酸根离子水解程度较低,则溶液中离子浓度大小顺序是[Na+]>[A-]>[OH-]>[H+],任何电解质溶液中都存在电荷守恒[Na+]+[H+]=[A-]+[OH-],所以只有D正确,
故选D.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,把握盐类水解原理即可解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.工业上从含硒的废液中提取硒的方法之一是:用硫酸和硝酸处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸(2HCl+H2SeO4=H2SeO3+Cl2↑+H2O),在亚硒酸溶液中通入SO2,有单质硒析出.下列说法错误的是( )
| A. | 氧化性:H2SeO4>Cl2H2SeO3>H2SO4 | |
| B. | 在SO2与亚硒酸的反应中,1mol H2SeO3参加反应转移4mol e- | |
| C. | 析出1mol硒需要消耗标准状况下22.4 L SO2 | |
| D. | 亚硒酸既有氧化性,又有还原性 |
1.你认为减少酸雨产生的途径可采取的措施是( )
①少用煤作燃料;②把工厂烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新的能源.
①少用煤作燃料;②把工厂烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新的能源.
| A. | ②③ | B. | ②③④⑤ | C. | ①③⑤ | D. | ①③④⑤ |
18.物质的变化千奇百怪,但概括起来就两大类,即物理变化和化学变化,下列说法正确的是( )
| A. | 有化学键破坏的变化一定属于化学变化 | |
| B. | 发生了颜色变化的一定是化学变化 | |
| C. | 有气泡产生或沉淀析出的变化一定是化学变化 | |
| D. | 燃烧一定是化学变化 |
16.硫酸亚铁(FeSO4)加热至高温会分解,生成一种金属氧化物M和两种非金属氧化物.某化学研究小组利用下列装置加热至高温使FeSO4分解.
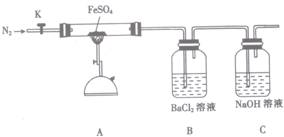
实验步骤:
将一定量FeSO4固体置于硬质玻璃管中,打开活塞K,通人一段时间N2,关闭活塞K.加热A中的玻璃管一段时间,待A中固体不再分解后,停止加热,打开K,缓慢通人氮气至玻璃管冷却.
(1)已知M中铁元素的质量分数为70%,M的化学式为Fe2O3.
(2)按图组装好仪器(已省略夹持仪器)并检查装置的气密性,在一定温度下按上述图示装置
进行实验.
(3)某同学欲验证硫酸亚铁分解产物中含有的另一种非金属氧化物N.
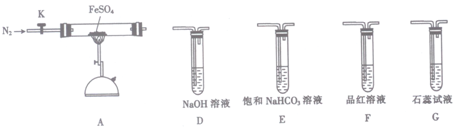
①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A→F→D.
②能证明生成了非金属氧化物N的现象是F中品红溶液褪色.

实验步骤:
将一定量FeSO4固体置于硬质玻璃管中,打开活塞K,通人一段时间N2,关闭活塞K.加热A中的玻璃管一段时间,待A中固体不再分解后,停止加热,打开K,缓慢通人氮气至玻璃管冷却.
(1)已知M中铁元素的质量分数为70%,M的化学式为Fe2O3.
(2)按图组装好仪器(已省略夹持仪器)并检查装置的气密性,在一定温度下按上述图示装置
进行实验.
| 操作步骤 | 实验现象 | 用化学方程式解释原因 |
| 打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间 | 洗气瓶B中①有白色沉淀生成 | ②SO3+H2O+BaCl2=BaSO4↓+2HCl |
| A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却 | 硬质玻璃管中最终可以看到③有红棕色固体物质生成 | ④2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑ |

①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A→F→D.
②能证明生成了非金属氧化物N的现象是F中品红溶液褪色.
 说法正确的是
说法正确的是
 的名称为3,3,4-三甲基己烷.
的名称为3,3,4-三甲基己烷.