题目内容
5.下列事实不能用勒夏特列原理(平衡移动原理)解释的是①铁在潮湿的空气中容易生锈;②二氧化氮与四氧化氮的平衡体系,加压缩小体积后颜色加深;③实验室可用排饱和食盐水的方法收集氯气;④开启啤酒瓶后,瓶中马上泛起大量泡沫;⑤加大压强,使N2和H2在一定的条件下转化为NH3;⑥工业上,采用高温的方法以提高SO2和O2反应生成SO3的产量(该反应为放热反应);⑦钠与氯化钾共融制备钾 Na(l)+KCl(l)?K(g)+NaCl(l)( )
| A. | ②④⑥⑦ | B. | ①⑦ | C. | ①②⑥ | D. | ①⑥⑦ |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:①铁在潮湿的空气中容易生锈不是可逆反应,不能用勒夏特列原理(平衡移动原理)解释,故符合;
②二氧化氮与四氧化氮的平衡体系,加压缩小体积后颜色加深,是因为体积变小,二氧化氮的浓度变大,与平衡移动无关,故符合;
③氯化钠在溶液中完全电离,所以饱和食盐水中含有大量的氯离子,氯气溶于水的反应是一个可逆反应,Cl2+H2O?ClO-+2H++Cl-,由于饱和食盐水中含有大量的氯离子,相当于氯气溶于水的反应中增加了大量的生成物氯离子,根据勒夏特列原理,平衡向逆反应方向移动,氯气溶解量减小,所以可以勒夏特列原理解释,故不选;
④开启啤酒瓶后,瓶中马上泛起大量泡沫,是压强对化学平衡的影响导致的,且存在可逆反应,故不选;
⑤工业上合成氨的反应是可逆反应,增大压强,化学平衡正向移动,有利于提高产物氨气的产率,能用勒夏特列原理解释,故不选;
⑥工业上,采用高温的方法以提高SO2和O2反应生成SO3的产量(该反应为放热反应),是加快反应速率,不能用勒夏特列原理(平衡移动原理)解释,故符合;
⑦Na(l)+KCl(l)?K(g)+NaCl(l)为可逆反应,能用勒夏特列原理解释,故不选;
故选C.
点评 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应.

练习册系列答案
相关题目
15.58号元素在周期表中的位置是( )
| A. | 第六周期ⅢA族 | B. | 第五周期ⅢA族 | C. | 第六周期ⅢB族 | D. | 第五周期ⅢB族 |
16.下列说法不正确的是( )
| A. | 聚合物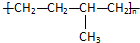 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 | |
| B. | 将1 mol明矾晶体完全溶于水制成胶体,其中所含胶体微粒数目为NA | |
| C. | 乙醇、苯酚、乙酸都有羟基,但是电离常数不同,这主要是基团之间相互影响造成的 | |
| D. | 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗用氧气的量依次减少 |
13.用相对分子质量为57的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为( )
| A. | 6 | B. | 9 | C. | 12 | D. | 16 |
20.被称为“国防金属”的镁,60%来自于海洋,从海水中提取镁的正确方法是( )
| 物质 | 氧化镁 | 氯化镁 |
| 熔点/℃ | 2 852 | 714 |
| A. | 海水$\stackrel{NaOH溶液}{→}$Mg(OH)2$\stackrel{通电}{→}$Mg | |
| B. | 海水$\stackrel{盐酸}{→}$MgCl2溶液-→MgCl2(熔融)$\stackrel{通电}{→}$Mg | |
| C. | 海水$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{盐酸}{→}$MgCl2溶液-→MgCl2(熔融)$\stackrel{通电}{→}$Mg | |
| D. | 海水$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{灼烧}{→}$MgO$\stackrel{通电}{→}$Mg |
10.下列说法正确的是( )
| A. | MgF2晶体中的化学键是共价键 | |
| B. | 在共价化合物中一定存在共价键 | |
| C. | N2和CH4两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 离子化合物一定只含离子键 |
17.下列反应属于加成反应的是( )
| A. | 由乙烯与水反应制乙醇 | B. | 由甲烷制四氯化碳 | ||
| C. | 苯与浓硫酸、硝酸混合 | D. | 点燃乙醇 |
15.下列关于元素周期表的叙述,错误的是( )
| A. | 第IA族元素全部是金属元素 | |
| B. | 过渡元素全是金属元素 | |
| C. | 第ⅦA族元素是同周期中非金属性最强的元素 | |
| D. | 在元素周期表中金属与非金属的分界线附近可以寻找制造半导体的材料 |