题目内容
18.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的①NaOH(固体) ②H2O ③HCl ④CH3COONa(固体)( )
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
分析 减缓反应速率应使盐酸溶液的浓度降低,因铁粉过量,如不影响生成氢气的总量,则所加入物质不能改变酸溶液所能电离出的H+离子总物质的量.
解答 解:①NaOH固体能与盐酸反应,减小生成氢气的总量,故①错误;
②加入H2O使盐酸溶液的浓度降低,反应速率减小,且不影响生成氢气的总量,故②正确;
③加入氯化氢可以使得产生氢气的量增加,故③错误;
④CH3COONa固体与盐酸反应生成弱电解质,溶液H+离子浓度降低,但不影响生成氢气的总量,故④正确;
故选D.
点评 本题考查化学反应速率的影响因素,题目难度不大,注意基础知识的积累是关键.

练习册系列答案
相关题目
8.下列四个图象的有关描述错误的是( )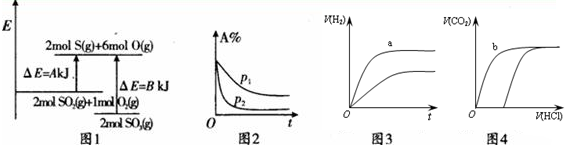
注:△E:表示能量,p表示压强;t表示时间,V表示体积,%表示B的体积百分含量.

注:△E:表示能量,p表示压强;t表示时间,V表示体积,%表示B的体积百分含量.
| A. | 图1表示化学反应2S02(g)+O2(g)?2S03(g)的能量变化,该反应的△H=A一BkJ/mol | |
| B. | 图2表示其他条件不变时,反应2A(g)+B(g)?c(g)+D(g)在不同压强下随时间的变化 | |
| C. | 图3表示体积和浓度均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 | |
| D. | 图4表示100 ml O.1 mol•L-Na2C03和NaHC03两种溶液中,分别逐滴滴加0.1 mol•L-1HCl,产生CO2 的体积随盐酸体积的变化,则b表示NaHCO3溶液 |
9.25℃时,浓度均为0.1mol•L-1的HA溶液和BOH溶液,pH分别是1和11.下列说法正确的是( )
| A. | 在0.1 mol•L-1BA溶液中c(A-)+c(H+)=c(BOH)+c(OH-) | |
| B. | 若将0.1 mol•L-1BOH溶液稀释至0.001 mol•L-1则溶液的pH=9 | |
| C. | 若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)>c(B+) | |
| D. | 若将上述两溶液按体积比1:2混合,则混合液中:c(B+)>c(A-)>c(OH-)>c(H+) |
6.关于下列各图的叙述中正确的是( )


| A. | 甲可表示乙酸溶液中通入氨气至过量过程中溶液导电性(I)的变化 | |
| B. | 乙可表示在恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 | |
| C. | 丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| D. | 丁表示常温下,稀释pH相同的HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则HA的酸性比HB的酸性强 |
3.下列各元素的性质或原子结构递变规律错误的是( )
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | P、S、Cl元素的最高正价依次升高 | |
| C. | Li、N、K的电子层数依次增多 | |
| D. | N、O、F原子半径依次增大 |
7.蒸干灼烧下列物质的水溶液,能得到该物质的是( )
| A. | AlC13 | B. | Fe2(SO4)3 | C. | NaHCO3 | D. | (NH4)2CO3 |

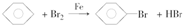 (催化剂也可以写FeBr3).
(催化剂也可以写FeBr3). 完成下列方程式
完成下列方程式