题目内容
8. 某研究性学习小组参照课文中的实验装置图做高温下铁与水蒸气反应的实验装置如图.在玻璃管中放入铁粉和石棉绒的混合物,加热,并通入水蒸气.用试管收集产生的干燥气体,并靠近火焰点火,观察现象.请回答下列问题:
某研究性学习小组参照课文中的实验装置图做高温下铁与水蒸气反应的实验装置如图.在玻璃管中放入铁粉和石棉绒的混合物,加热,并通入水蒸气.用试管收集产生的干燥气体,并靠近火焰点火,观察现象.请回答下列问题:(1)在圆底烧瓶内放入少许碎瓷片,其作用是防止暴沸.
(2)写出铁与高温水蒸气反应的化学方程式3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2.
(3)实验时将铁粉与石棉绒混合以及在反应管的两端均放入少量石棉绒,其原因可能是(填序号)C.
A.石棉绒的作用是催化剂 B.石棉绒的作用是使铁粉受热均匀
C.石棉绒的作用是作铁粉的载体以及防止铁粉被吹入导管而引起堵塞
(4)干燥管中盛装的物质是碱石灰(或无水CaCl2),作用是吸收水蒸气,干燥氢气.
分析 (1)在圆底烧瓶内放入少许碎瓷片主要是防止暴沸;
(2)铁与水蒸气发生氧化还原反应,生成Fe3O4和H2;
(3)实验时将铁粉与石棉绒混合以及在反应管的两端均放入少量石棉绒主要是防止铁粉被吹入导管而引起堵塞;
(4)根据干燥管主要是干燥氢气来判断.
解答 解:(1)加热液体时要防止暴沸,故应加入少量碎瓷片防止暴沸发生,故答案为:防止暴沸;
(2)铁与水蒸气发生氧化还原反应,生成Fe3O4和H2:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2;
故答案为:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2;
(3)实验时将铁粉与石棉绒混合以及在反应管的两端均放入少量石棉绒主要是防止铁粉被吹入导管而引起堵塞;
故选:C;
(4)因为最后生成的气体为氢气,干燥氢气可以用碱石灰;
故答案为:碱石灰;吸收水蒸气,干燥氢气.
点评 本题考查了物质的制备、物质成分的探究实验,题目侧重于考查学生的实验探究能力,注意把握铁及其化合物的性质,题目难度不大.

练习册系列答案
相关题目
7.下列电离方程式中书写正确的是( )
| A. | NaHSO4?Na++H++SO42- | B. | H2S?H++HS-、HS-?H++S2- | ||
| C. | HClO=H++ClO- | D. | NaHCO3?Na++H++CO32- |
3.红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛.
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO•Cr2O3)利用以下过程来制取.

①步骤I中反应的化学方程式为:
4FeO•Cr2O3(s)+8Na2CO3(s)+7O2=8Na2Cro4(s)+2Fe2O3+8CO2该反应的化学平衡常数的表达式为K=$\frac{c(C{O}_{2})^{8}}{c({O}_{2})^{7}}$,在常温下该反应速度极慢,下列措施中能使反应速率增大的是ABC.
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是NaA1O2[或NaA1(OH)4]、Na2SiO3.
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是除去A1O-2、SiO32-等杂质.
④步骤Ⅳ中发生反应的离子方程式为:2CrO42-+2H+=Cr2O72-+H2O.
(2)将红矾钠与KCl固体按1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体.请填写表中空格,完成上述过程.(已知:在室温下重铬酸钾溶解度很小,而在升高温度时,其溶解度大大增加).
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO•Cr2O3)利用以下过程来制取.

①步骤I中反应的化学方程式为:
4FeO•Cr2O3(s)+8Na2CO3(s)+7O2=8Na2Cro4(s)+2Fe2O3+8CO2该反应的化学平衡常数的表达式为K=$\frac{c(C{O}_{2})^{8}}{c({O}_{2})^{7}}$,在常温下该反应速度极慢,下列措施中能使反应速率增大的是ABC.
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是NaA1O2[或NaA1(OH)4]、Na2SiO3.
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是除去A1O-2、SiO32-等杂质.
④步骤Ⅳ中发生反应的离子方程式为:2CrO42-+2H+=Cr2O72-+H2O.
(2)将红矾钠与KCl固体按1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体.请填写表中空格,完成上述过程.(已知:在室温下重铬酸钾溶解度很小,而在升高温度时,其溶解度大大增加).
| 序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
| ① | 溶解 | 将混合物放入烧杯中,加入热的蒸馏水,充分搅拌直到固体不再溶解. |
| ② | ||
| ③ | ||
| ④ | ||
| ⑤ | 过滤、干燥 | 得到K2Cr2O7晶体 |
13.如图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是( )
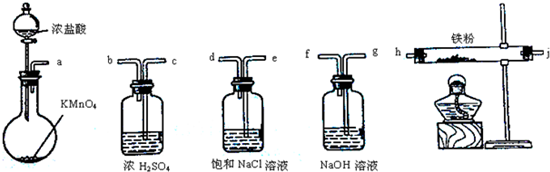

| A. | a-b-c-d-e-e-f-g-h | B. | a-e-d-c-b-h-j-g | ||
| C. | a-d-e-c-b-h-j-g | D. | a-c-b-d-e-h-j-f |
17.为探究Na、Mg、Al的金属活动性顺序,某课外小组同学进行了如下实验:
他们记录的实验现象有:
请帮助该小组同学补充下列实验报告中的内容.
(1)在下表中填写与实验相对应的实验现象序号:
(2)写出钠与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(3)实验结论是金属活动性顺序为Na>Mg>Al.
(4)用原子结构理论对上述实验结论进行解释:同周期元素从左至右,原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐碱性,原子核对电子的引力逐渐增强,失电子能力逐渐减弱,因此金属性逐渐减弱.
| 实验 | 1、将一小块金属钠放入滴有酚酞溶液的冷水中. 2、将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液. 3、将一小段镁带投入稀盐酸中. 4、将一小片铝投入稀盐酸中. |
| 实验 现象 | ①剧烈反应,迅速生成大量的气体. ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红. ③反应不剧烈,产生无色气体. ④有气体产生,溶液变成红色. |
(1)在下表中填写与实验相对应的实验现象序号:
| 实验 | 1 | 2 | 3 | 4 |
| 实验现象 |
(3)实验结论是金属活动性顺序为Na>Mg>Al.
(4)用原子结构理论对上述实验结论进行解释:同周期元素从左至右,原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐碱性,原子核对电子的引力逐渐增强,失电子能力逐渐减弱,因此金属性逐渐减弱.
18.下列关于碱金属的叙述中不正确的是( )
| A. | 碱金属单质在化学反应中表现出强还原性 | |
| B. | Li 在氧气中燃烧主要生成Li2O2 | |
| C. | 碱金属离子的氧化性随着离子半径的增大而减小 | |
| D. | 随核电荷数的增加,单质与水反应剧烈程度增大 |
 向Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,其沉淀的质量W和加入NaOH体积V之间的关系如图所示.则混合溶液中Al2(SO4)3和MgSO4的物质的量之比为1:2.
向Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,其沉淀的质量W和加入NaOH体积V之间的关系如图所示.则混合溶液中Al2(SO4)3和MgSO4的物质的量之比为1:2.