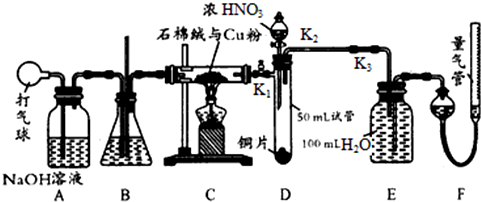
题目内容
需要加入适当氧化剂才能实现的变化是( )
| A、P→PCl5 |
| B、HNO3→NO2 |
| C、Cl2→Cl- |
| D、KClO3→KCl |
考点:氧化还原反应
专题:氧化还原反应专题
分析:加入适当氧化剂才能实现,则选项中为还原剂的氧化反应,还原剂中某元素的化合价升高,以此来解答.
解答:
解:A.P元素的化合价升高,需要加氧化剂实现,故A选;
B.N元素的化合价降低,可自身发生氧化还原反应,或加还原剂实现,故B不选;
C.Cl元素的化合价降低,可自身发生氧化还原反应,如氯气与NaOH反应,故C不选;
D.Cl元素的化合价降低,可自身发生氧化还原反应,如氯酸钾分解,故D不选;
故选A.
B.N元素的化合价降低,可自身发生氧化还原反应,或加还原剂实现,故B不选;
C.Cl元素的化合价降低,可自身发生氧化还原反应,如氯气与NaOH反应,故C不选;
D.Cl元素的化合价降低,可自身发生氧化还原反应,如氯酸钾分解,故D不选;
故选A.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及自身氧化还原反应的判断为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)═Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表,下列说法正确的是( )
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A、上述生成Ni(CO)4的反应为吸热反应 |
| B、25℃时,反应Ni(CO)4(g)═Ni(s)+4CO(g)的平衡常数为2×10-5 |
| C、80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol?L-1 |
| D、80℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol?L-1,则此时υ(正)>υ(逆) |
如图是四种常见有机物的比例模型示意图.下列说法正确的是( )
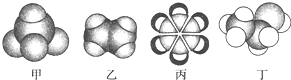

| A、甲能使酸性KMnO4溶液褪色 |
| B、乙可与溴水发生取代反应而使溴水褪色 |
| C、丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特键 |
| D、丁在稀硫酸作用下可与乙酸发生取代反应 |
下列对合金描述不正确的是( )
| A、合金最多只能含有两种元素 |
| B、多数合金的硬度较大 |
| C、多数合金的熔点比成分金属低 |
| D、合金的性能跟合金元素的种类有关 |
在无色透明的强酸性溶液中可以大量共存的离子组是( )
| A、Na+、NO3-、Mg2+、Cl- |
| B、Na+、CO32-、NO3-、Ca2+ |
| C、K+、Cl-、SO42-、Cu2+ |
| D、Ba2+、Cl-、K+、SO42- |
某含Na+的溶液中,可能还存在NH4+、Fe2+、Br-、CO32-、I-、SO42-六种离子中的一种或几种.进行以下实验
由此可以推知该溶液中肯定不存在的离子是( )
①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;
②向橙黄色溶液中加入BaCl2溶液时,无沉淀生成;
③橙黄色溶液不能使淀粉变蓝.
由此可以推知该溶液中肯定不存在的离子是( )
①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;
②向橙黄色溶液中加入BaCl2溶液时,无沉淀生成;
③橙黄色溶液不能使淀粉变蓝.
| A、NH4+、Br-、CO32- |
| B、NH4+、I-、SO42- |
| C、Fe2+、I-、SO42- |
| D、Fe2+、CO32-、I- |