题目内容
7.在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单质碘: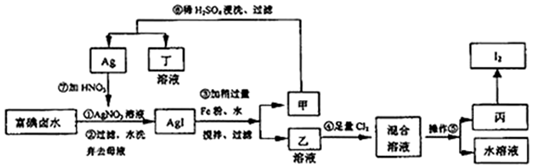
(1)步骤③加Fe粉的目的是使碘化银转化成碘化亚铁(FeI2)和单质银(或将难溶的碘化银转化成可溶的碘化亚铁).
(2)写出步骤④中反应的离子方程式2Fe2++4I-+3Cl2=2I2+2Fe3++6Cl-.
(3)上述生产流程中,可以循环利用的副产物是Ag(或AgNO3).
(4)操作⑤的名称是萃取分液,选用的试剂是CCl4.
(5)AgI见光易变黑,其原因(用化学方程式表示)2AgI $\frac{\underline{\;光照\;}}{\;}$2Ag+I2,写出AgI两种主要用途人工降雨和感光材料.
分析 流程分析富碘卤水中加入硝酸银溶液过滤洗涤得到AgI,加入铁屑水反应是碘单质Ag和FeI2,判断乙为FeI2,通入适量氯气反应生成I2,利用碘单质易升华,易溶解于有机溶剂中提纯碘单质;Ag稀硫酸清洗后得到银和硝酸反应生成硝酸银循环利用,
(1)依据图示流程,过滤水洗后的甲为AgI,加入Fe搅拌,可得Ag和FeI2;
(2)乙溶液为具有还原性的FeI2,向其中通Cl2,氯气氧化碘离子和二价铁离子;
(3)依据流程图可知,Ag(或AgNO3)可循环利用;
(4)利用溶解度的不同进行萃取,分离I2和FeCl3溶液,通常选择萃取剂将碘水中的碘萃取出来;
(5)AgI见光易变黑是碘化银见光分解生成银河碘单质,可以用来人工降雨,也可以做感光材料.
解答 解:依据流程分析富碘卤水中加入硝酸银溶液过滤洗涤得到AgI,加入铁屑、水反应是碘单质Ag和FeI2,判断乙为FeI2,通入适量氯气反应生成I2,利用碘单质易升华,易溶解于有机溶剂中提纯碘单质;Ag稀硫酸清洗后得到银和硝酸反应生成硝酸银循环利用,
(1)富碘卤水中含有I-,加入硝酸银发生:Ag++I-═AgI↓,过滤水洗后的甲为AgI,加入Fe搅拌,可得Ag和FeI2,
故答案为:使碘化银转化成碘化亚铁(FeI2)和单质银(或将难溶的碘化银转化成可溶的碘化亚铁);
(2)FeI2具有还原性,与充足的氯气发生氧化还原反应生成I2和FeCl3,反应的化学方程式为2FeI2+3Cl2═2I2+2FeCl3,
故答案为:2Fe2++4I-+3Cl2=2I2+2Fe3++6Cl-;
(3)由流程图可看出,副产物为Ag,由于加入的Fe过量,所以在甲中先加入稀硫酸除去Fe,再加入稀硝酸与Ag反应制得AgNO3溶液,所以Ag(或AgNO3)可循环利用,
故答案为:Ag(或AgNO3);
(4)碘在CCl4中的溶解度大于在水中的溶解度,CCl4和水不互溶,且CCl4和碘不反应,分离I2和FeCl3溶液方法是加入CCl4有机溶剂进行萃取、分液,
故答案为:萃取、分液;CCl4;
(5)AgI见光易变黑是碘化银见光分解生成银河碘单质,反应的化学方程式为:2AgI $\frac{\underline{\;光照\;}}{\;}$2Ag+I2,AgI两种主要用途是可以用来人工降雨,也可以做感光材料
故答案为:2AgI $\frac{\underline{\;光照\;}}{\;}$2Ag+I2; 人工降雨,感光材料.
点评 本题考查单质碘的制备,题目难度中等,注意根据物质的性质认真分析流程图的反应过程,正确判断各物质是解答该题的关键.

| A. | 推广和鼓励多使用公共交通工具出行 | |
| B. | 植树造林,绿化环境 | |
| C. | 利用廉价煤炭,大力发展火力发电 | |
| D. | 对燃煤进行脱硫,减少空气的污染 |
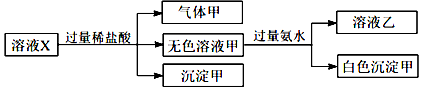
| A. | 气体甲一定是纯净物 | |
| B. | 沉淀甲是硅酸和硅酸钙的混合物 | |
| C. | Na+、AlO2-和SiO32-一定存在于溶液X中 | |
| D. | CO32-和SO42-一定不存在于溶液X中 |
| A. | 1,1-二氯乙烯 | B. | 丙烯 | C. | 1-丁烯 | D. | 2-戊烯 |
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 2mol SO 2、1mol O 2 | 4mol SO 3 |
| n (SO 3)/mol | 1.6 | a |
| 反应物的转化率 | α 1 | α 2 |
| A. | α 1+α 2>1 | |
| B. | 1.6<a<3.2 | |
| C. | 若甲中反应2 min时达到平衡,则2 min 内平均速率 ν (O 2)=“0.2“molL -1min -1 | |
| D. | 甲平衡后再加入0.2 mol SO 2、0.2 mol O 2和0.4 mol SO 3,平衡逆向移动 |
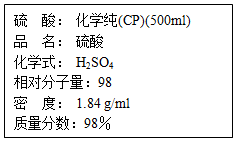 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容: