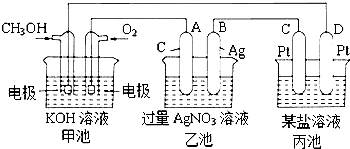
题目内容
1.阿伏加德罗常数约为6.02×1023mol-1,下列说法不正确的是( )| A. | 常温下,42 g乙烯和丁烯的混合气体中含有的碳原子数为3×6.02×1023 | |
| B. | 1mol碳正离子(CH5+)中含电子数为10×6.02×1023 | |
| C. | 1mol Cu和足量浓硝酸反应产生 2×6.02×1023个NO2分子 | |
| D. | 30 g乙烷中所含极性共价键数目为7×6.02×1023 |
分析 A、乙烯和丁烯的最简式均为CH2;
B、碳正离子(CH5+)中含10个电子;
C、铜和硝酸反应后变为+2价,根据得失电子数守恒来分析;
D、求出乙烷的物质的量,然后根据乙烷中含6条极性共价键来分析.
解答 解:A、乙烯和丁烯的最简式均为CH2,故42g混合物中含有的CH2的物质的量为3mol,故含有3NA个碳原子,故A正确;
B、碳正离子(CH5+)中含10个电子,故1mol碳正离子中含10NA个电子,故B正确;
C、铜和硝酸反应后变为+2价,故1mol铜失去2mol电子,设生成的二氧化氮的物质的量为xmol,则有:2mol=xmol×1,解得x=2mol,故生成的二氧化氮的分子个数为2NA个,故C正确;
D、30g乙烷的物质的量为1mol,而乙烷中含6条极性共价键,故1mol乙烷中含6NA条极性共价键,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
12.设NA为阿伏伽德罗常数的值.下列有关叙述正确的是( )
| A. | 1molFeCl3完全水解得到的胶体粒子数小于NA | |
| B. | 1molN2与3molH2反应生成的NH3分子数为2NA | |
| C. | 1molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 标准状况下,2.24LSO3含有O原子数为0.3NA |
9.某盐的混合物中含有0.2mol/L Na+、0.4mol/L Mg2+、0.4mol/L Clˉ,则SO42ˉ为( )
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
16.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3H2O能大量共存 |
| C | 将可调高度的铜丝伸入到稀NHO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,震荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+<I2 |
| A. | A | B. | B | C. | C | D. | D |
10.已知维生素A的结构简式如图,关于它的叙述不正确的是( )


| A. | 1mol维生素A在氧气中燃烧,一定能生成20mol CO2 | |
| B. | 维生素A能发生酯化反应 | |
| C. | 1mol维生素A在催化剂作用下最多能与5mol H2发生加成反应 | |
| D. | 维生素A能使酸性KMnO4溶液褪色 |
10.没食子酸丙酯(简称PG)是脂溶性食品抗氧化剂,其结构简式如图:下列有关说法不正确的是( )
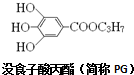

| A. | 没食子酸的分子式为C10H13O5 | B. | 1molPG可与4molNaOH反应 | ||
| C. | PG中的基团-C3H7有两种结构 | D. | PG有还原性,易被氧化 |

 .
.