题目内容
 Ⅰ.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2+H2?CO+H2O,
Ⅰ.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2+H2?CO+H2O,回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的转化率为50%.若把体系温度降至800℃求得平衡常数K1=0.81,可以推知该反应的正反应为
(2)T℃时,某时刻测得体系中各物质的量如下:n(CO2)=1.2mol,n(H2)=1.5mol,
n(CO)=0.9mol,n(H2O)=0.9mol,则此时该反应
(填“向正反应方向”“向逆反应方向”或“处于平衡状态”).
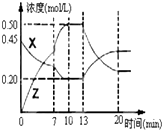
II.向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s)?2Z(g);△H<0.如图是容器中X、Z的物质的量浓度随时间变化的曲线.
(1)0~10min 容器内气体的压强逐渐
(2)推测在第7min时曲线变化的原因可能是
第13min时曲线变化的原因可能是
①增加Z的量 ②增加X的量 ③升温
④降温 ⑤使用催化剂.
考点:物质的量或浓度随时间的变化曲线,化学平衡常数的含义,化学平衡的影响因素
专题:化学平衡专题
分析:Ⅰ、(1)依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到反应的平衡常数,和800°C平衡常数比较判断能量变化;
(2)依据浓度商计算和平衡常数比较分析判断反应进行的方向;
Ⅱ、(1)根据反应前后气体的化学计量数之和进行判断;
(2)升高温度或使用催化剂可以加快化学反应速率;升高温度,平衡向吸热的方向移动.
(2)依据浓度商计算和平衡常数比较分析判断反应进行的方向;
Ⅱ、(1)根据反应前后气体的化学计量数之和进行判断;
(2)升高温度或使用催化剂可以加快化学反应速率;升高温度,平衡向吸热的方向移动.
解答:
解:I.(1)在1L容器中通入CO2、H2各2mol,在一定条件下发生反应,
CO2+H2?CO+H2O
起始量(mol/L) 2 2 0 0
变化量(mol/L)2×50% 1 1 1
平衡量(mol/L)1 1 1 1
K=1
若把体系温度降至800℃求得平衡常数K1=0.81<K=1,说明降低温度平衡常数减小,平衡逆向进行,逆向为放热反应正反应为吸热反应;
故答案为:吸热;
(2)T℃时,某时刻测得体系中各物质的量如下:n(CO2)=1.2mol,n(H2)=1.5mol,n(CO)=0.9mol,n(H2O)=0.9mol,Q=
=0.45
小于平衡常数,则反应正向进行;
故答案为:向正反应方向;
II.(1)反应前气体的化学计量数之和为1,反应后气体的化学计量数之和为2,故0~10min 容器内气体的压强逐渐变大;故答案为:变大;
(2)第7min时,单位时间内X、Z的物质的量变化量较大,反应速率明显增大,可能为升高温度或者使用催化剂;第13min时,Z的物质的量减小,X的物质的量增大,说明平衡向逆反应方向移动,该反应为放热反应,应为升高温度,故答案为:③⑤;③.
CO2+H2?CO+H2O
起始量(mol/L) 2 2 0 0
变化量(mol/L)2×50% 1 1 1
平衡量(mol/L)1 1 1 1
K=1
若把体系温度降至800℃求得平衡常数K1=0.81<K=1,说明降低温度平衡常数减小,平衡逆向进行,逆向为放热反应正反应为吸热反应;
故答案为:吸热;
(2)T℃时,某时刻测得体系中各物质的量如下:n(CO2)=1.2mol,n(H2)=1.5mol,n(CO)=0.9mol,n(H2O)=0.9mol,Q=
| 0.9×0.9 |
| 1.2×1.5 |
小于平衡常数,则反应正向进行;
故答案为:向正反应方向;
II.(1)反应前气体的化学计量数之和为1,反应后气体的化学计量数之和为2,故0~10min 容器内气体的压强逐渐变大;故答案为:变大;
(2)第7min时,单位时间内X、Z的物质的量变化量较大,反应速率明显增大,可能为升高温度或者使用催化剂;第13min时,Z的物质的量减小,X的物质的量增大,说明平衡向逆反应方向移动,该反应为放热反应,应为升高温度,故答案为:③⑤;③.
点评:本题考查化学平衡以及反应速率等问题,平衡常数计算和判断,题目难度中等,注意图象曲线变化的分析,把握外界条件对反应速率和平衡移动的影响.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
关于容量瓶的叙述:①是配制准确浓度溶液的仪器; ②瓶上只标有容积;③不能用来加热;④使用之前要检查是否漏水;⑤只能用磨口玻璃塞; ⑥不宜贮存溶液.这些叙述中正确的是( )
| A、①③④ | B、①③④⑥ |
| C、①②④ | D、②③④⑥ |
用于制造飞机的材料应具备高比强度(断裂强度/密度),还应具备密度小、质地轻的特点.以波音747为例,机身每减轻1kg,因耗油减少,一年可获利2000美元.你认为下列材料中可用于飞机制造业是( )
| A、Mg Al合金 |
| B、黄铜(Cu Zn合金) |
| C、Na K合金 |
| D、生铁(Fe C合金) |
 如何降低大气中CO2的含量及有效地开发利用CO2是当前科学家研究的重要课题.
如何降低大气中CO2的含量及有效地开发利用CO2是当前科学家研究的重要课题.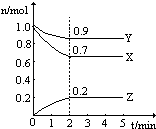 温度一定,在一个10L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.试根据图中数据,填写下列空白:
温度一定,在一个10L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.试根据图中数据,填写下列空白: 碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.
碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质. (1)在298K时,1mol C2H6在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ.写出该反应的热化学方程式
(1)在298K时,1mol C2H6在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ.写出该反应的热化学方程式 (1)某课外兴趣小组对过氧化氢的分解速率做了如下实验探究.下表是该小组研究影响过氧化氢速率的因素时采集的一组数据:
(1)某课外兴趣小组对过氧化氢的分解速率做了如下实验探究.下表是该小组研究影响过氧化氢速率的因素时采集的一组数据: