题目内容
 (1)在298K时,1mol C2H6在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ.写出该反应的热化学方程式
(1)在298K时,1mol C2H6在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ.写出该反应的热化学方程式(2)利用该反应设计一个燃料电池:用KOH溶液作电解质溶液,多孔石墨作电极,在电极上分别通入乙烷和氧气.通入乙烷气体的电极应为
(3)在图1所示实验装置中,石墨棒上的电极反应式为
(4)将普通碳钢钉放入“84消毒液”(NaClO溶液)中浸泡一段时间.预期的实验现象是
(5)为了进一步探究碳钢钉在该消毒液(NaClO)中的腐蚀原理,某同学设计了如图2所示实验装置,写出碳(C)极上发生的电极反应式
考点:原电池和电解池的工作原理,热化学方程式
专题:化学反应中的能量变化,电化学专题
分析:(1)1mol C2H6在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ,则2mol乙烷完全燃烧放出3116.6 kJ热量,据此书写热化学反应方程式;
(2)燃料电池中,负极上燃料失电子发生氧化反应;
(3)根据电子流动方向知,石墨是阳极、铁电极是阴极,阳极上氢氧根离子放电、阴极上铜离子放电;
根据“析出什么加入什么”原则加入物质;
(4)该装置构成原电池,铁作负极、C作正极,负极上生成亚铁离子、正极上生成氢氧根离子;
(5)正极上次氯酸根离子得电子发生还原反应.
(2)燃料电池中,负极上燃料失电子发生氧化反应;
(3)根据电子流动方向知,石墨是阳极、铁电极是阴极,阳极上氢氧根离子放电、阴极上铜离子放电;
根据“析出什么加入什么”原则加入物质;
(4)该装置构成原电池,铁作负极、C作正极,负极上生成亚铁离子、正极上生成氢氧根离子;
(5)正极上次氯酸根离子得电子发生还原反应.
解答:
解:(1)1mol C2H6在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ,则2mol乙烷完全燃烧放出3116.6 kJ热量,所以其热化学反应方程式为2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H=-3116.6 kJ?mol-1,
故答案为:2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H=-3116.6 kJ?mol-1;
(2)燃料电池中,负极上燃料乙烷失电子发生氧化反应生成碳酸根离子和水,电极反应式为C2H6+18OH--14e-=2CO32-+12H2O,
故答案为:负; C2H6+18OH--14e-=2CO32-+12H2O;
(3)根据电子流动方向知,石墨是阳极、铁电极是阴极,阳极上氢氧根离子放电,石墨电极反应式为4OH--4e-=2H2O+O2↑,阴极上铜离子放电生成铜,所以看到的现象是墨电极表面有气泡产生,铁电极上附着一层红色物质,溶液颜色变浅;
阳极上析出氧气、阴极上析出铜,所以相当于析出CuO,电池反应式为2CuSO4+2H2O
2H2SO4+2Cu+O2↑,pH=1时溶液中氢离子浓度为0.1mol/L,则溶液中n(H2SO4)=0.05mol/L×1L=0.05mol,阴极析出n(Cu)=
×2=0.05mol,根据“析出什么加入什么”原则,根据Cu原子守恒知析出m(CuO)=n(Cu).M(CuO)=0.05mol×80g/mol=4g,也可以加入碳酸铜,其质量=0.05mol×124g/mol=6.2g,
故答案为:4OH--4e-=2H2O+O2↑;石墨电极表面有气泡产生,铁电极上附着一层红色物质,溶液颜色变浅;氧化铜(或碳酸铜);4g(或6.2g);
(4)该装置构成原电池,负极上铁失电子生成亚铁离子,正极上有氢氧根离子生成,亚铁离子和氢氧根离子生成氢氧化亚铁,氢氧化亚铁易被氧化生成氢氧化铁,所以钢钉表面有红褐色物质生成,故答案为:钢钉表面有红褐色物质生成;
(5)正极上次氯酸根离子得电子和水生成氯离子好氢氧根离子,电极反应式为ClO-+H2O+2e-=Cl-+2OH-,故答案为:ClO-+H2O+2e-=Cl-+2OH-.
故答案为:2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H=-3116.6 kJ?mol-1;
(2)燃料电池中,负极上燃料乙烷失电子发生氧化反应生成碳酸根离子和水,电极反应式为C2H6+18OH--14e-=2CO32-+12H2O,
故答案为:负; C2H6+18OH--14e-=2CO32-+12H2O;
(3)根据电子流动方向知,石墨是阳极、铁电极是阴极,阳极上氢氧根离子放电,石墨电极反应式为4OH--4e-=2H2O+O2↑,阴极上铜离子放电生成铜,所以看到的现象是墨电极表面有气泡产生,铁电极上附着一层红色物质,溶液颜色变浅;
阳极上析出氧气、阴极上析出铜,所以相当于析出CuO,电池反应式为2CuSO4+2H2O
| ||
| 0.05mol |
| 2 |
故答案为:4OH--4e-=2H2O+O2↑;石墨电极表面有气泡产生,铁电极上附着一层红色物质,溶液颜色变浅;氧化铜(或碳酸铜);4g(或6.2g);
(4)该装置构成原电池,负极上铁失电子生成亚铁离子,正极上有氢氧根离子生成,亚铁离子和氢氧根离子生成氢氧化亚铁,氢氧化亚铁易被氧化生成氢氧化铁,所以钢钉表面有红褐色物质生成,故答案为:钢钉表面有红褐色物质生成;
(5)正极上次氯酸根离子得电子和水生成氯离子好氢氧根离子,电极反应式为ClO-+H2O+2e-=Cl-+2OH-,故答案为:ClO-+H2O+2e-=Cl-+2OH-.
点评:本题考查了原电池原理,明确电子流向、各个电极上发生的反应是解本题关键,再结合转移电子守恒、原子守恒进行计算,注意(3)题要使溶液恢复原状也可以加入碳酸铜,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某有机物的结构为: ,能发生的反应类型有( )
,能发生的反应类型有( )
①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥中和 ⑦缩聚.
 ,能发生的反应类型有( )
,能发生的反应类型有( )①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥中和 ⑦缩聚.
| A、①③⑥ | B、①②⑤⑥ |
| C、②③④⑦ | D、除⑤外 |
以下物质间的转化通过一步反应不能实现的是( )
| A、Fe→FeCl2→FeCl3→Fe(OH)3 |
| B、Na→Na2O2→Na2CO3→NaHCO3 |
| C、Al→Al2O3→Al(OH)3→AlCl3 |
| D、Na→NaOH→NaHCO3→Na2CO3 |
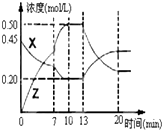 Ⅰ.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2+H2?CO+H2O,
Ⅰ.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2+H2?CO+H2O,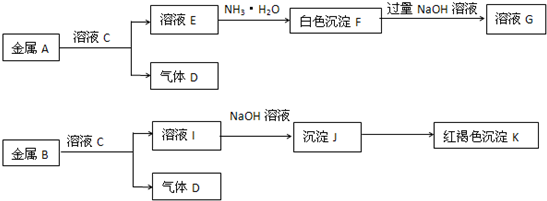
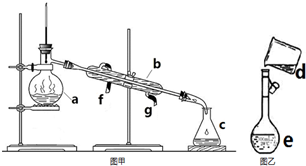 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.