题目内容
18.20mL 0.1000mol•L-1氨水用0.1000mol•L-1的盐酸滴定,滴定曲线入如图,下列说法正确的是( )
| A. | 该中和滴定适宜用酚酞作指示剂 | |
| B. | 两者恰好中和时,溶液的pH=7 | |
| C. | 达到滴定终点时,溶液中:c(H+)=c(OH-)+c(NH3•H2O) | |
| D. | 当滴入盐酸达30mL时,溶液中c(NH4+)+c(H+)<c(OH-)+c(Cl-) |
分析 A.反应终点生成氯化铵,水解显酸性;
B.两者恰好中和时生成氯化铵;
C.物料守恒式为c(NH4+)+c(NH3•H2O)=c(Cl-),电荷守恒式为c(NH4+)+c(H+)=c(OH-)+c(Cl-);
D.溶液不显电性,遵循电荷守恒.
解答 解:A.反应终点生成氯化铵,水解显酸性,酚酞的变色范围为8~10,应选甲基橙作指示剂,故A错误;
B.两者恰好中和时生成氯化铵,溶液的pH<7,故B错误;
C.物料守恒式为c(NH4+)+c(NH3•H2O)=c(Cl-),电荷守恒式为c(NH4+)+c(H+)=c(OH-)+c(Cl-),则c(H+)=c(OH-)+c(NH3•H2O),故C正确;
D.溶液不显电性,遵循电荷守恒,则当滴入盐酸达30mL时,溶液中c(NH4+)+c(H+)=c(OH-)+c(Cl-),故D错误;
故选C.
点评 本题考查酸碱混合的定性判断,为高频考点,把握滴定终点的酸碱性、电荷及物料守恒式为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的易错点,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.下列有关物质性质的说法错误的是( )
| A. | 热稳定性:HCl>HI | B. | 结合质子能力:S2->Cl- | ||
| C. | 原子半径:Ge>As | D. | 酸性:HNO2>HNO3 |
9.苯环实际上不具有碳碳单键和双键的交替结构,可以作为证据的事实有( )
①苯的间位二取代物只有一种
②苯的邻位二取代物只有一种
③苯分子中碳碳键的键长均相等
④苯不能使酸性KMnO4溶液褪色
⑤苯在加热和催化剂存在条件下,与氢气发生加成反应
⑥苯在FeBr3存在的条件下,与液溴发生取代反应,但不能因化学变化而使溴水褪色.
①苯的间位二取代物只有一种
②苯的邻位二取代物只有一种
③苯分子中碳碳键的键长均相等
④苯不能使酸性KMnO4溶液褪色
⑤苯在加热和催化剂存在条件下,与氢气发生加成反应
⑥苯在FeBr3存在的条件下,与液溴发生取代反应,但不能因化学变化而使溴水褪色.
| A. | ①②③④ | B. | ②③④⑥ | C. | ③④⑤⑥ | D. | 全部 |
6.一定温度下,在3个体积均为1.0L的恒容密闭容器中发生反应X(g)+Y(g)?2Z(g)△H<0并达到平衡,部分数据如表所示.下列有关说法正确的是( )
| 容器 | 温度/℃ | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(X) | c(Y) | c(Z) | c(Z) | ||
| I | 758 | 0.2 | 0.1 | 0 | 0.1 |
| Ⅱ | 758 | 0.1 | 0.05 | 0 | |
| Ⅲ | 858 | 0.2 | 0.1 | 0 | |
| A. | 从开始至平衡时,容器I中Z的反应速率为0.044 mol•L-1•s-1 | |
| B. | 平衡时,容器Ⅱ中Z的浓度为0.05 mol•L-1 | |
| C. | 平衡时,容器Ⅲ中Z的浓度大于0.1 mol•L-1 | |
| D. | 若起始时向容器I中充入0.02 mol X、0.01 mol Y和0.02 mol Z,则反应向正反应方向进行 |
13.对于0.2mol•L-1的CaCl2溶液,下列有关说法正确的是( )(NA表示阿伏伽德罗常数)
| A. | 含Ca2+数目为0.1NA | B. | Cl-的物质的量浓度为0.4mol•L-1 | ||
| C. | 含钙元素质量为4g | D. | 含CaCl2的质量分数为22.2% |
3.如图是部分短周期主族元素原子半径与原子序数的关系图,下列说法错误的是( )

| A. | 电解熔融的X与Z构成的化合物可以得到单质Z | |
| B. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| C. | R的单质在过量的O2中燃烧,可得到R的最高价氧化物 | |
| D. | 同周期元素形成的最简单氢化物中,X的沸点最高 |
1.研究小组同学对金属镁与NH4Cl溶液的反应产生了浓厚的兴趣.可供选择的实验试剂为:镁粉,1mol/L NH4Cl溶液,1mol/L盐酸溶液,1.0mol/LCH3COONH4溶液,1.0mol/LKNO3溶液,1.0mol/LNaCl溶液
(1)研究小组做了如下几组实验,请完成下面表格(表中不要留空格):
从实验结果得知,常温下镁几乎不和水反应,却很容易与NH4Cl,NH4NO3溶液反应产生气体,实验②的目的是验证铵根离子能和镁反应,但同学们认为这个方案还应该补充:NaNO3溶液与镁作用.
(2)研究小组提出如下猜测:
假设一:NH4+是这个反应的催化剂,能促进水和镁反应:
假设二:Cl-是镁和水反应的催化剂;
假设三:NH4+水解溶液呈酸性…
请写出NH4Cl水解反应离子反应方程式:NH4++H2O?NH3•H2O+H+.
(3)研究小组发现除了生产氢气外,还生成了能使湿润的红色石蕊试纸测变蓝的气体.请简写出用试纸测试气体的过程取湿润的红色石蕊试纸粘在玻璃棒上,靠近出气口,试纸变蓝,说明生成氨气(4)为验证假设二,请你设计一个实验方案,写出实验步骤和结论.
(1)研究小组做了如下几组实验,请完成下面表格(表中不要留空格):
| 编号 | 镁粉/g | H2O/mL | NH4Cl溶液/mL | NH4NO3溶液/mL |
| ① | 5 | 0 | 20 | 0 |
| ② | 5 | 0 | 0 | 20 |
| ③ | 5 | 20 | 0 | 0 |
(2)研究小组提出如下猜测:
假设一:NH4+是这个反应的催化剂,能促进水和镁反应:
假设二:Cl-是镁和水反应的催化剂;
假设三:NH4+水解溶液呈酸性…
请写出NH4Cl水解反应离子反应方程式:NH4++H2O?NH3•H2O+H+.
(3)研究小组发现除了生产氢气外,还生成了能使湿润的红色石蕊试纸测变蓝的气体.请简写出用试纸测试气体的过程取湿润的红色石蕊试纸粘在玻璃棒上,靠近出气口,试纸变蓝,说明生成氨气(4)为验证假设二,请你设计一个实验方案,写出实验步骤和结论.
| 实验步骤(不要求写出具体操作过程): 增加一组镁与NaCl溶液的作用的实验 实验结论常温下镁几乎不和NaCl溶液反应 |
19.在容积不变的密闭容器中存在如下反应:2A(g)+B(s)?2C(g)△H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )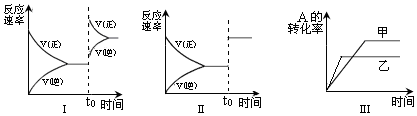

| A. | 图I研究的是t0时刻增大A的浓度对反应速率的影响 | |
| B. | 图II研究的是t0时刻加入催化剂或通入氦气使压强增大后对反应速率的影响 | |
| C. | 图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高 | |
| D. | 图III研究的是温度对化学平衡的影响,且乙的温度较高 |
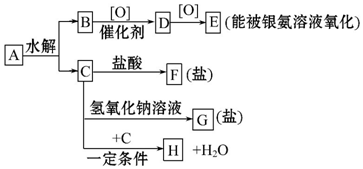
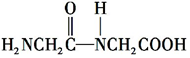 +H2O.
+H2O.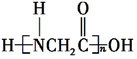 +(n-1)H2O.
+(n-1)H2O.