题目内容
工业上正在研究利用CO2来生产甲醇燃料,该方法的化学方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g) ?H=-49.0kJ/mol,一定温度下,在三个容积均为3.0L的恒容密闭容器中发生该反应:
CH3OH(g)+H2O(g) ?H=-49.0kJ/mol,一定温度下,在三个容积均为3.0L的恒容密闭容器中发生该反应:
容器 | 起始物质的量/mol | 平衡物质的量/mol | |||
编号 | 温度/℃ | CO2(g) | H2(g) | CH3OH(g) | H2O(g) |
Ⅰ | T1 | 3 | 4 | 0.5 | 0.5 |
Ⅱ | T1 | 1.5 | 2 | ||
Ⅲ | T2 | 3 | 4 | 0.8 | 0.8 |
下列有关说法不正确的是
A.若经过2min容器I中反应达平衡,则2min内平均速率V(H2)=0.25 mol/(L·min)
B.达到平衡时,容器I中CO2转化率的比容器Ⅱ的大
C.达到平衡时,容器Ⅲ中反应放出的热量比容器Ⅱ的2倍少
D.若容器Ⅰ、Ⅱ、Ⅲ中对应条件下的平衡常数分别为K1、K2、K3,则K1=K2<K3
C
【解析】
试题分析:A根据方程式可知每产生1mol的水会消耗3mol的H2。由于反应达到平衡时产生水的物质的量是0.5mol,所以消耗的H2的物质的量是1. 5mol,所以2min内平均速率V(H2)= 1.5mol ÷3.0L÷2min=0.25 mol/(L·min),正确;B.容器I、容器Ⅱ反应的温度相同,由于反应物的物质的量容器I>容器Ⅱ,及压强: 容器I>容器Ⅱ,增大压强平衡向气体体积减小的正反应方向移动,所以达到平衡时,容器I中CO2转化率的比容器Ⅱ的大,正确;C.对于容器Ⅰ、Ⅲ来说,反应物的开始浓度相同,达到平衡时,Ⅲ的生成物浓度大,说明平衡正向移动,由于该反应的正反应是放热反应,所以根据平衡移动原理:降低温度,平衡向放热的正反应方向移动,因此温度容器Ⅲ<容器Ⅰ。由于容器Ⅲ中温度低于容器Ⅰ,加入平衡不发生移动,因为Ⅲ物质的量浓度是Ⅰ的2倍,反应放热是容器Ⅱ的2倍,而平衡正向移动,使反应放出的热量比2倍要多,错误;D.若容器Ⅰ、Ⅱ是温度相同,所以平衡常数相同,而容器Ⅲ中对应温度低,降低温度,平衡正向移动,化学平衡常数增大,所以三个容器在该反应条件下的平衡常数分别为K1、K2、K3,则K1=K2<K3,正确。
考点:考查温度】压强对化学平衡常数、物质的转化率、化学反应速率的影响的知识。

下述根据下列操作和现象,所得结论正确的是
实验操作及现象 | 实验结论 | |
A | 分别向2 mL 0.1 mol·L-1 CH3COOH溶液和2 mL 0.1 mol·L-1 H3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象 | 酸性: CH3COOH > H2CO3> H3BO3 |
B | 向浓度均为0.1 mol·L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3溶液,产生黄色沉淀 | 溶度积: Ksp(AgCl)<Ksp(AgI) |
C | 向无水乙醇中加入浓H2SO4,加热,产生的气体通入酸性KMnO4溶液,紫色褪去 | 证明生成了乙烯 |
D | 将少量的溴水滴入NaI溶液中,再滴加CCl4,振荡、静置,溶液分为两层:上层溶液无色,下层溶液紫红色 | 氧化性:Br2>I2 |

 。
。
 并检验其氧化产物,其装置连接顺序是A→_____→_____→_____→D(除D装置外,其它装置不能重复使用),最后D装置中所加药品为________ ___,其作用是
并检验其氧化产物,其装置连接顺序是A→_____→_____→_____→D(除D装置外,其它装置不能重复使用),最后D装置中所加药品为________ ___,其作用是 ___________。
___________。

 2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示: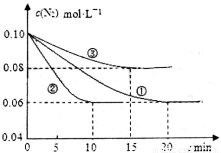
 H2O的电离平衡常数Kb=________________。
H2O的电离平衡常数Kb=________________。