题目内容
下列变化过程中,熵在减小(即△S<O)的是( )
|
A.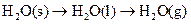 | B.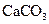 ══ ══ 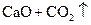 | C.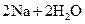 ══ ══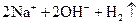 | D.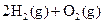 ══ ══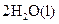 |
D
熵值的大小比较规律有:①同一种物质,三种状态下,熵值的大小顺序为:S(g)>S(l)>S(s);②对于确定的产生气体的反应,气体的物质的量增加的反应都是熵值增加的反应,气体的物质的量减小的反应都是熵值减小的反应,所以D正确。

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
 (Ⅰ)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)
(Ⅰ)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)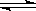 2NH3(g),其部分工艺流程如下:
2NH3(g),其部分工艺流程如下:

 写出表示N2H4燃烧热的热化学方程式是 。
写出表示N2H4燃烧热的热化学方程式是 。
 Si(s) + 4HCl(g);△H =" +" Q kJ/mol(Q>0),一定温度、压强下,将一定量的反应物充入密闭容器中进行以上反应,下列叙述正确的是( )
Si(s) + 4HCl(g);△H =" +" Q kJ/mol(Q>0),一定温度、压强下,将一定量的反应物充入密闭容器中进行以上反应,下列叙述正确的是( ) 2SO3(g) ,SO2的起始浓度是0.4 mol·L-1,O2的起始浓度是1 mol·L-1。当SO2的转化率为80%时,反应达到平衡状态
2SO3(g) ,SO2的起始浓度是0.4 mol·L-1,O2的起始浓度是1 mol·L-1。当SO2的转化率为80%时,反应达到平衡状态 ℃时反应2A(g)
℃时反应2A(g) B(g);△H达到平衡时混合气体平均分子量(数值上等于混合气体的总质量除以总物质的量)为
B(g);△H达到平衡时混合气体平均分子量(数值上等于混合气体的总质量除以总物质的量)为 ,
, ℃时该反应平衡混合气体的平均分子量为
℃时该反应平衡混合气体的平均分子量为 ,当平衡从
,当平衡从 ,平衡向右移动,
,平衡向右移动,
 ,平衡向左移动,
,平衡向左移动,
