题目内容
溴水中存在着如下的平衡:Br2+H2O?HBr+HBrO,若要使溴水的颜色变浅,可采取的措施是( )
| A、加压 |
| B、加入NaF晶体 |
| C、通入SO2气体 |
| D、通入HF气体 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:若要使溴水的颜色变浅,可以通过改变条件使化学平衡向正反应方向移动,也可能加入能和溴发生反应的某些物质,结合溴的性质分析解答.
解答:
解:A.该反应中没有气体参加或生成,加压对该平衡无影响,所以不能使溴水颜色变浅,故A错误;
B.加入氟化钠晶体,氢溴酸的酸性大于氢氟酸,所以氢溴酸和氟化钠反应,促进平衡向正反应方向移动,所以能使溴水颜色变浅,故B正确;
C.通入二氧化硫,溴具有强氧化性,在水溶液溴能氧化二氧化硫生成硫酸,自身被还原生成氢溴酸,所以能使溴水颜色变浅,故C正确;
D.氟化氢和水反应生成氢氟酸,氢氟酸电离出氢离子导致溶液中氢离子浓度增大,所以平衡向逆反应方向移动,则溴水浓度增大颜色变深,故D错误;
故选BC.
B.加入氟化钠晶体,氢溴酸的酸性大于氢氟酸,所以氢溴酸和氟化钠反应,促进平衡向正反应方向移动,所以能使溴水颜色变浅,故B正确;
C.通入二氧化硫,溴具有强氧化性,在水溶液溴能氧化二氧化硫生成硫酸,自身被还原生成氢溴酸,所以能使溴水颜色变浅,故C正确;
D.氟化氢和水反应生成氢氟酸,氢氟酸电离出氢离子导致溶液中氢离子浓度增大,所以平衡向逆反应方向移动,则溴水浓度增大颜色变深,故D错误;
故选BC.
点评:本题考查了氧化还原反应、化学平衡移动,明确物质的性质是解本题关键,易错选项是C,注意二氧化硫能和溴发生氧化还原反应而使化学平衡移动,为易错点.

练习册系列答案
相关题目
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A、标准状况下,22.4 L CO2和O2混合气体中含有的氧分子数约为NA |
| B、常温常压下,0.1 mol Fe在0.1 mol Cl2中充分燃烧,转移的电子数为0.2NA |
| C、标准状况下,11.2L NO与11.2L O2 混合后所含原子数为2NA |
| D、电解精炼铜时,电解池中每转移1mol电子,阳极上溶解的铜原子数为0.5 NA |
在高炉炼铁中将铁矿石还原成单质的需要还原剂是( )
| A、CaCO3 |
| B、C |
| C、SiO2 |
| D、CO |
阿伏加德罗常数约为6.02×1023 mol-1,下列叙述中正确的是( )
| A、常温常压下,18.0 g重水(D2O)所含的电子数约为10×6.02×1023 | ||
| B、室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数约为3×6.02×1023 | ||
| C、标准状况下,22.4 L甲苯所含的分子数约为6.02×1023 | ||
D、标准状况下,a L甲烷和乙烷混合气体中的分子数约为
|
设NA代表阿伏加德罗常数,下列说法正确的是( )
| A、31 g白磷所含共价键数目为4NA |
| B、2 L pH=1的盐酸与醋酸溶液中氢离子数均为0.2 NA |
| C、标准状况下,2.24L C4H6所含碳原子数为0.6 NA |
| D、标准状况下,22g CO2含有的电子数为0.5 NA |
化学用语是表示物质组成、结构和变化规律的一种具有国际性、科学性和规范性的书面语言.下列化学用语中表述正确的是( )
A、次氯酸的电子式: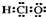 |
| B、二氧化硅的分子式:SiO2 |
C、二氧化碳的比例模型: |
D、Cl-的结构示意图: |
要除去CO2中混有的少量HCl气体,最好的方法是将气体通过( )
| A、饱和NaHCO3溶液 |
| B、Na2CO3溶液 |
| C、饱和石灰水 |
| D、烧碱溶液 |
 肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.