题目内容
铅蓄电池用途极广,电解液为30% H2SO4溶液,电池的总反应式可表示为:
Pb(s)+PbO2(s)+2H2SO4(aq)
2PbSO4(s)+2H2O(l),下列有关叙述正确的是( )
Pb(s)+PbO2(s)+2H2SO4(aq)
| 放电 |
| 充电 |
| A、放电时电解液的密度不断增大 |
| B、放电时电子从Pb通过导线转移到PbO2 |
| C、充电时Pb极与外电源的正极相连 |
| D、充电时PbO2电极发生还原反应,Pb电极上发生氧化反应 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A.铅蓄电池工作时,硫酸参加反应生成硫酸铅,溶液中氢离子浓度降低;
B.放电时,该装置是原电池,铅作负极,二氧化铅作正极,负极上铅失电子发生氧化反应,正极上二氧化铅得电子发生还原反应,放电时,电子从负极沿导线流向正极;
C.充电时,原来材料为铅的电极与外加电源的负极相连,为阴极;
D.电池充电,属于电解池,阳极发生氧化反应,阴极发生还原反应;
B.放电时,该装置是原电池,铅作负极,二氧化铅作正极,负极上铅失电子发生氧化反应,正极上二氧化铅得电子发生还原反应,放电时,电子从负极沿导线流向正极;
C.充电时,原来材料为铅的电极与外加电源的负极相连,为阴极;
D.电池充电,属于电解池,阳极发生氧化反应,阴极发生还原反应;
解答:
解:A.铅蓄电池工作时,负极电解反应:Pb-2e-+SO42-=PbSO4 ,正极电极反应:PbO2+2e-+4H++2SO42-=PbSO4+2H2O,根据电池反应式知,硫酸是反应物,所以随着反应的进行,硫酸的浓度逐渐减小,导致密度减小,故A错误;
B.放电时,电子从负极沿导线流向正极,铅作负极,二氧化铅作正极,放电时电子从Pb通过导线转移到PbO2,故B正确;
C.充电时,两极的PbSO4分别转化为Pb和PbO2,原来材料为二氧化铅的电极与外加电源的正极相连,发生氧化反应,原来材料为铅的电极与外加电源的负极相连,为阴极,发生还原反应,故C错误;
D.电池充电,属于电解池,两极的PbSO4分别转化为Pb和PbO2,阳极原来材料为二氧化铅的电极与外加电源的正极相连,发生氧化反应,阳极反应式为:PbSO4+2H2O-2e-═PbO2+4H++SO42-,阴极原来材料为铅的电极与外加电源的负极相连,发生还原反应,电极反应式为PbSO4+2e-=Pb+SO42-,故D错误;
故选B.
B.放电时,电子从负极沿导线流向正极,铅作负极,二氧化铅作正极,放电时电子从Pb通过导线转移到PbO2,故B正确;
C.充电时,两极的PbSO4分别转化为Pb和PbO2,原来材料为二氧化铅的电极与外加电源的正极相连,发生氧化反应,原来材料为铅的电极与外加电源的负极相连,为阴极,发生还原反应,故C错误;
D.电池充电,属于电解池,两极的PbSO4分别转化为Pb和PbO2,阳极原来材料为二氧化铅的电极与外加电源的正极相连,发生氧化反应,阳极反应式为:PbSO4+2H2O-2e-═PbO2+4H++SO42-,阴极原来材料为铅的电极与外加电源的负极相连,发生还原反应,电极反应式为PbSO4+2e-=Pb+SO42-,故D错误;
故选B.
点评:本题考查原电池和电解池的工作原理,侧重于学生的分析能力的考查,题目难度中等,明确各个电极上发生的反应是解本题关键.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
3.9g镁铝合金恰好完全溶解于120mL4mol/L的盐酸中,再加入60mL8mol/L的氢氧化钠溶液,得到沉淀10.7g,则加入盐酸时产生氢气的物质的量为(mol)( )
| A、0.17 | B、0.18 |
| C、0.20 | D、0.21 |
氯化硼(BCl3)常用作医药生产中的催化剂.三氯化硼中,氯元素的化合价为-l,则硼元素的化合价为( )
| A、-3 | B、-2 | C、0 | D、+3 |
某同学欲配制含有大量下列各离子的溶液,其中能实现的是( )
A、Fe3+、NH
| ||
B、K+、H+、SO
| ||
C、Fe2+、Fe3+、Na+、NO
| ||
D、Fe2+、NH
|
在有机物分子中能够引入羟基的反应有( )
①取代反应 ②加成反应 ③消去反应 ④氧化反应 ⑤还原反应 ⑥加聚反应.
①取代反应 ②加成反应 ③消去反应 ④氧化反应 ⑤还原反应 ⑥加聚反应.
| A、①②③④ | B、②③④⑤ |
| C、①②④⑤ | D、①②⑤⑥ |
下列各组物质中,所含元素的质量分数相同,但它们既不属于同分异构体,也不属于同系物的是( )
| A、乙烯 丙烯 |
| B、2-甲基-1,3-丁二烯 3-甲基-1-丁炔 |
| C、甲烷 乙烯 |
| D、苯 苯乙烯 |
最近研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子的最外层都满足8电子结构,结合已学知识,判断有关说法正确的是( )
A、羰基硫的电子式为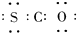 |
| B、羰基硫分子的中心原子为氧 |
| C、羰基硫中三个原子处于同一直线上 |
| D、羰基硫是非极性分子 |
下列溶液的导电能力变化最大(忽略溶液体积变化)的是( )
| A、向100mL含有0.05 molHCI的溶液中加入等物质的量的NaOH固体 |
| B、向100mL含有0.05 molCH3COOH的溶液中通入等物质的量的氨气 |
| C、向100mL含有0.05 molHCI的溶液中加入等物质的量的NaHCO3固体 |
| D、向100mL含有0.05 molCa(OH)2的澄清石灰水中通入标况下224mLCO2气体 |