题目内容
13.下列各组性质排列的顺序正确的是( )| A. | 离子半径:F->Na+>Mg2+>Al3+ | B. | 热稳定性:HCl<H2S<PH3 | ||
| C. | 酸性:H2SiO3>H2CO3>H3PO4 | D. | 熔点:NaCl>SiO2>CO2 |
分析 A.电子层结构相同核电荷数越大,离子半径越小,电子层越多离子半径越大;B.根据元素的非金属性越强其对应的氢化物越稳定;C.根据元素的非金属性越强其对应的最高价氧化物对应的水化物的酸性越强;D.根据熔点:原子晶体>离子晶体>分子晶体分析.
解答 解:A.F-、Na+、Mg2+、Al3+离子核外电子排布相同,核电核数F<Na<Mg<Al则有F->Na+>Mg2+>Al3+,故A正确;B.因元素的非金属性越强其对应的氢化物越稳定,非金属性:Cl>S>P,所以HCl>H2S>PH3,故B错误;C.因元素的非金属性越强其对应的最高价氧化物对应的水化物的酸性越强,非金属性:C>Si,
酸性:H2CO3>H2SiO3,故C错误;D.SiO2为原子晶体,NaCl为离子晶体,CO2为分子晶体,熔点顺序:原子晶体>离子晶体>分子晶体,故D错误;故选A.
点评 本题考查元素周期律知识,题目难度不大,注意相关性质的比较角度以及元素周期律的主要递变规律.

练习册系列答案
相关题目
3.伞形酮可有雷琐苯乙酮和苹果酸在一定条件下反应制得,下列说法错误的是( )
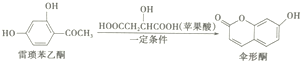

| A. | 雷梭苯乙酮有两种含氧官能团 | |
| B. | 1mol伞形酮与足量NaOH溶液反应,最多可消耗2mol NaOH | |
| C. | 伞形酮难溶于水 | |
| D. | 雷梭苯乙酮和伞形酮都能跟FeCl3溶液发生显色反应 |
4.在一定条件下,1mol白磷转化为红磷放出29.2KJ热能.在该条件下,下列说法正确的是( )
| A. | 白磷比红磷的能量低 | |
| B. | 白磷比红磷稳定 | |
| C. | 该变化为物理变化 | |
| D. | 该变化的本质是旧化学键断裂,新化学键形成 |
1.合成氨是人类科学技术上的一项重大突破,曾三次获诺贝尔化学奖,下列说法错误的是( )
| A. | 合成氨技术实现了“从空气到面包” | |
| B. | 合成氨涉及氧化还原反应 | |
| C. | 高效催化剂是合成氨反应的重要条件 | |
| D. | 合成氨所需要的氢气主要来自于电解水 |
8.纪录片《舌尖上的中国》展示了中化饮食文化的博大精深.下列烹饪用品的调味成分属于无机物的是( )
| A. | 香醋 | B. | 食盐 | C. | 麻油 | D. | 黄酒 |
18.下列各组反应(表中物质均为反应物),在反应刚开始时,放出H2的速率最大的是( )
| 金属(粉末状)mol | 酸的浓度及体积 | 反应温度 | |
| A | Zn 0.1 | 6mol/L硝酸 10mL | 70℃ |
| B | Zn 0.1 | 3mol/L硫酸 10mL | 70℃ |
| C | Fe 0.1 | 3mol/L盐酸 10mL | 60℃ |
| D | Zn 0.1 | 3mol/L盐酸 10mL | 60℃ |
| A. | A | B. | B | C. | C | D. | D |
5.若在加入铝粉能放出氢气的溶液中,下列各组离子可能共存的是( )
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、Ba2+、Mg2+、HCO3- | ||
| C. | NO3-、K+、[Al(OH)4]-、OH- | D. | NO3-、Mg2+、K+、Cl- |
2.下列说法正确的是( )
| A. | 石油的催化重整和煤的干馏均可以得到芳香烃,说明石油和煤中含有芳香烃 | |
| B. | 石油裂解的目的主要是为了得到更多的汽油 | |
| C. | 石油分馏得到的产物可用来萃取溴水中的溴 | |
| D. | 石油裂化主要得到的是乙烯、丙烯等 |
3.我国科学家成功地研制出长期依赖进口、价格昂贵的物质${\;}_{8}^{18}$O2.下列说法正确的是( )
| A. | 它是一种新元素 | |
| B. | 它和O3互为同素异形体 | |
| C. | ${\;}_{8}^{18}$O2与${\;}_{2}^{16}$O2互为同位素 | |
| D. | 1mol ${\;}_{8}^{18}$O2分子中含有20mol电子 |