题目内容
4.设NA代表阿伏加德罗常数,下列叙述正确的是(C-12 H-1)( )| A. | 标准状况下,22.4LCCl4所含的分子数为NA | |
| B. | 1mol的羟基(-OH)与1 mol的氢氧根(OH -)离子所含电子数均为9 NA | |
| C. | 常温常压下,在30g 的乙烷气体分子中,碳氢键的总个数为6NA | |
| D. | 一定条件下,将2molSO2与足量的O2充分反应,生成SO3的分子数为2NA |
分析 A、标况下四氯化碳为液体;
B、氢氧根中含10个电子;
C、求出乙烷的物质的量,然后根据乙烷中含6条碳氢键来分析;
D、二氧化硫和氧气的反应为可逆反应.
解答 解:A、标况下四氯化碳为液体,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、氢氧根中含10个电子,故1mol氢氧根中含10NA个电子,故B错误;
C、30g乙烷的物质的量为1mol,而乙烷中含6条碳氢键,故1mol乙烷中含6NA条碳氢键,故C正确;
D、二氧化硫和氧气的反应为可逆反应,不能进行彻底,故生成的三氧化硫分子个数小于2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.设NA为阿伏加德罗常数值,下列有关叙述正确的是( )
| A. | 28gMgCO3和NaHCO3混合固体中的CO32-离子数为NA | |
| B. | lmolI2与4molH2反应生成的HI分子数为2NA | |
| C. | 1molAl溶于含1molNaOH溶液,电子转移数为3NA | |
| D. | 标准状况下,2.24LH2O含有的共价键数为0.2NA |
9.钛合金烤瓷牙是目前国内使用最为普遍的一种烤瓷牙,TiCl4是生产金属钛的原料.
(1)工业上主要用TiO2氯化的方法来制取TiCl4
①有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g),写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
②工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4,从化学平衡的角度解释此方法能顺利制取TiCl4的原因加入的碳单质与氧气反应,减小了产物O2的浓度,使 TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)平衡向正反应方向移动,使反应能够顺利进行.
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4,装置如图1所示:

如表是有关物质的性质:
①实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是先排尽系统(装置)中的空气.
②本实验中仪器a采用题给的加热方式的突出优点是受热均匀,能为反应提供稳定的CCl4蒸汽流.
③B中CCl4与TiO2发生反应的化学方程式是TiO2+CCl4$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+CO2↑.
④欲分离C装置中的TiCl4,应采用的实验操作为蒸馏(填操作名称).
⑤若将反应过程中生成的气体X(足量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图2所示,若混合溶液中Ba( OH)2和2NaOH的物质的量之比为1:1,则b点溶液中溶质主要成分的化学式为NaHCO3,从b点到c点,沉淀减少过程中发生反应的离子方程式为BaCO3+H2O+CO2=Ba2++2HCO3-.
(1)工业上主要用TiO2氯化的方法来制取TiCl4
①有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g),写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
②工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4,从化学平衡的角度解释此方法能顺利制取TiCl4的原因加入的碳单质与氧气反应,减小了产物O2的浓度,使 TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)平衡向正反应方向移动,使反应能够顺利进行.
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4,装置如图1所示:

如表是有关物质的性质:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76.8 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
②本实验中仪器a采用题给的加热方式的突出优点是受热均匀,能为反应提供稳定的CCl4蒸汽流.
③B中CCl4与TiO2发生反应的化学方程式是TiO2+CCl4$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+CO2↑.
④欲分离C装置中的TiCl4,应采用的实验操作为蒸馏(填操作名称).
⑤若将反应过程中生成的气体X(足量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图2所示,若混合溶液中Ba( OH)2和2NaOH的物质的量之比为1:1,则b点溶液中溶质主要成分的化学式为NaHCO3,从b点到c点,沉淀减少过程中发生反应的离子方程式为BaCO3+H2O+CO2=Ba2++2HCO3-.
16.化学与科学、技术、社会、环境密切相关,下列有关说法不正确的是( )
| A. | 墨水是一种胶体,不同墨水混用时可能使钢笔流水不畅或者堵塞 | |
| B. | 持续加热到一定温度能杀死甲型H1N1流感病毒是因为病毒的蛋白质受热变性 | |
| C. | 洁厕液与84消毒液混合洗厕所可以达到洗涤和消毒杀菌的双重功效,对人体不可能造成伤害 | |
| D. | 用13C示踪原子法可以进行幽门螺旋杆菌的精确检测 |
13.将烧碱溶液和盐酸一次滴入某溶液A中,其沉淀(Y轴)和加入溶液的体积(X轴)的关系可能出现两种图示形式,则A溶液不可能是( )


| A. | 三溴化铝溶液 | B. | 偏铝酸钠溶液 | C. | 明矾溶液 | D. | 硝酸铝溶液 |
14.某化合物的结构(键线式)及球棍模型如图1:该有机分子的核磁共振波谱图如图2(单位是ppm).下列关于该有机物的叙述正确的是( )
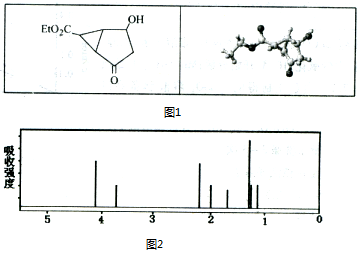

| A. | 该有机物不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物在一定条件下能够发生加成反应、取代反应,但不能发生消去反应 |
