题目内容
10.Cl2与I2在一定条件下发生反应:Cl2+I2+H2O→HIO3+HCl,当把方程式配平后,氧化剂与还原剂之比为5:1.分析 氧化还原反应中化合价升降一定相等,该反应中氯气为氧化剂,碘单质为还原剂,根据化合价变化列式计算氧化剂与还原剂的物质的量之比.
解答 解:反应Cl2+I2+H2O→HIO3+HCl中,Cl2中氯原子从而0价变为-1价被还原,Cl2为氧化剂,1mol氯气反应化合价降低2mol;
I2的化合价从0价变为HIO3中的+5价,化合价升高5价,HIO3为还原剂,1mol碘单质完全反应化合价升高5×1mol×2=10mol,
氧化还原反应中化合价升降相等,设氯气的物质的量为x、碘单质的物质的量为y,则2x=10y,整理可得:x:y=5:1,
所以该反应中氧化剂与还原剂的物质的量之比为5:1,
故答案为:5:1.
点评 本题考查了氧化还原反应,题目难度不大,明确氧化还原反应的特征为解答关键,注意掌握配平氧化还原反应的方法,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.

练习册系列答案
 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
1.化学科学需要借助化学专用语言来描述,下列化学用语的书写正确的是( )
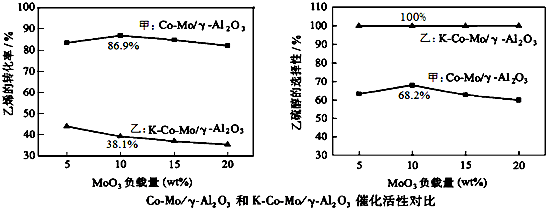
| A. | Ca2+的结构示意图为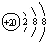 | B. | CO2分子的比例模型示意图: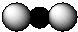 | ||
| C. | 水合钠离子: | D. | 次氯酸的电子式: |
18.盐酸具有的化学性质是( )
| A. | 酸性 | B. | 酸性、氧化性 | ||
| C. | 酸性、还原性 | D. | 酸性、氧化性、还原性 |
9.对于反应A(s)+3B(g)?2C(g)+2D(g),改变下列条件会使反应速率增大的是( )
| A. | 添加A物质 | B. | 升高体系温度 | C. | 及时分离出C物质 | D. | 减少B物质 |
10.下列相关反应的离子方程式书写正确的是( )
| A. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| B. | 硫酸铜溶液显酸性:Cu2++2H2O=Cu(OH)2↓+2H+ | |
| C. | 向碳酸氢铵溶液中加过量澄清石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |