题目内容
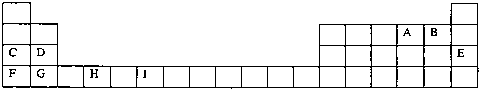
(14分)下表为周期表的一部分,其中的编号代表对应的元素。
(1)写出上表中的元素⑩原子的外围电子排布式 。
(2)元素⑦与⑧形成的化合物的晶体类型是 。
(3)元素④的第一电离能 (填“>”、“=”或“<”)元素⑤的第一电离能;元素④与元素①形成的X分子的空间构型为 。X沸点高于同族其它元素与元素①形成的化合物的沸点,其原因是 。
(4)第四周期所有元素的基态原子中,4p轨道半充满的是 (请填元素符号,下同),3d轨道半充满的原子是 ,4s轨道半充满的是 。
(5)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,其离子方程式为 .
(1) 。(1分) (2) 离子晶体。(1分)
。(1分) (2) 离子晶体。(1分)
(3) > ( 1分) 三角锥形 (1分)X分子间易形成氢键 (2分)
(4) As(1分); Cr Mn(2分,各1分); K Cr Cu(3分,各1分)
(5)4NH3 + Cu2+=Cu(NH3)42+( 2分)
解析

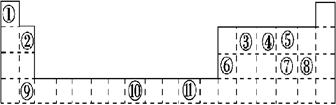
(13分)下表为周期表的一部分,表中所列的字母分别代表一种化学元素。
|
a |
|
|
|
|
|||||||||||||
|
|
|
|
|
b |
c |
d |
|
|
|||||||||
|
|
|
|
|
|
e |
f |
|
|
|||||||||
|
|
|
|
|
|
g |
|
h |
|
|
|
|
|
|
|
|
|
|
用化学用语回答下列问题:
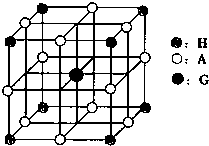
(1)写出元素g的基态原子核外电子排布式___________________________,
h2+中未成对电子数为 。
(2)在b2a2分子中,元素b为 杂化,该分子是 分子(填“极性”或“非极性”),该分子中σ键和π键的数目比为 。
(3) bd2与bf2比较,沸点较高的是_______(填分子式),原因是 。
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙正确是 。
A.h位于元素周期表中第四周期第VIII族,属于d区元素
B.e的基态原子中,3p能级为半充满,属于p区元素
C.最外层电子排布式为4s2,一定属于IIA族
D.最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族
(5)科学研究表明,元素b与元素c可以形成一种超硬、耐磨、耐高温的新型无机非金属材料,其化学式为 ,其熔点比金刚石 (填“高”或“低”)。


 其价电子排布式__________。第四周期中电子排布4s轨道上电子数与之相同的还有 元素(填元素符号)。
其价电子排布式__________。第四周期中电子排布4s轨道上电子数与之相同的还有 元素(填元素符号)。