题目内容
下表为周期表的一部分,其中的字母代表对应的元素
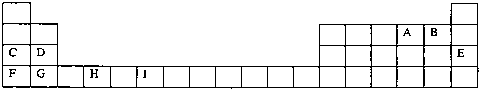
请回答下列问题:
(1)写出元素I的基态原子的价电子排布式 ;已知M2+离子3d轨道中有6个电子,试推出M元素位于周期表的 周期 族.
(2)请列举F的金属性比C强的实验事实: ,并用原子结构理论解释其原因: .
(3)在标准状况下,根据M=
测定B的气态氢化物的相对分子质量,结果发现,测定结果总比理论值高,其原因是 .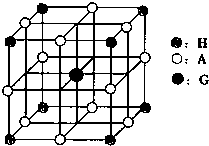
(4)H、A、G三种元素形成的晶体是一种矿物的主要成分,其晶胞结构如图,则该晶体的化学式为 ;在该晶体中,G离子的配位数为 ;若晶胞的边长为acm,则晶体的密度为 g/cm3.

请回答下列问题:
(1)写出元素I的基态原子的价电子排布式
(2)请列举F的金属性比C强的实验事实:
(3)在标准状况下,根据M=
| m | n |

(4)H、A、G三种元素形成的晶体是一种矿物的主要成分,其晶胞结构如图,则该晶体的化学式为
分析:由元素在周期表中的位置可知,A为氧,B为氟,C为钠,D为镁,E为氩,F为钾,G为钙,H为钛,I为铬,
(1)Cr原子核外电子数为24,结合构造原理与洪特规则特例书写其价电子排布式;M2+离子3d轨道中有6个电子,则M原子价电子排布式为3d64s2,为Fe元素,处于第四周期第Ⅷ族;
(2)可以根据与水反应剧烈程度或最高价氧化物对应的水化物的碱性强弱等说明金属性强弱;结合原子半径大小分析原子核对核外电子的吸引解答;
(3)B的气态氢化物HF分子间存在氢键,缔合成(HF)n;
(4)根据均摊法计算晶胞中各原子数目,据此书写化学式;由晶胞结构可知,由G最近的A原子位于晶胞棱中间,据此判断其配位数;根据晶胞中含有的原子数目计算晶胞质量,再计算晶胞体积,根据ρ=
计算晶胞的密度.
(1)Cr原子核外电子数为24,结合构造原理与洪特规则特例书写其价电子排布式;M2+离子3d轨道中有6个电子,则M原子价电子排布式为3d64s2,为Fe元素,处于第四周期第Ⅷ族;
(2)可以根据与水反应剧烈程度或最高价氧化物对应的水化物的碱性强弱等说明金属性强弱;结合原子半径大小分析原子核对核外电子的吸引解答;
(3)B的气态氢化物HF分子间存在氢键,缔合成(HF)n;
(4)根据均摊法计算晶胞中各原子数目,据此书写化学式;由晶胞结构可知,由G最近的A原子位于晶胞棱中间,据此判断其配位数;根据晶胞中含有的原子数目计算晶胞质量,再计算晶胞体积,根据ρ=
| m |
| V |
解答:解:由元素在周期表中的位置可知,A为氧,B为氟,C为钠,D为镁,E为氩,F为钾,G为钙,H为钛,I为铬,
(1)Cr原子核外电子数为24,由洪特规则特例可知,其价电子排布式为3d54s1;M2+离子3d轨道中有6个电子,则M原子价电子排布式为3d64s2,为Fe元素,处于第四周期第Ⅷ族;
故答案为:3d54s1;四、Ⅷ;
(2)相同条件下与水反应,钾比钠剧烈(或最高价氧化物对应的水化物的碱性:KOH>NaOH),可以说明金属性K比Na强,根据原子结构,虽然钾的核电荷数比钠多,但钾的半径比钠大,核对最外层电子的引力钾比钠小,故钾易失去电子,金属性强,
故答案为:相同条件下与水反应,钾比钠剧烈(或最高价氧化物对应的水化物的碱性:KOH>NaOH);虽然钾的核电荷数比钠多,但钾的半径比钠大,核对最外层电子的引力钾比钠小,故钾易失去电子,金属性强;
(3)B的气态氢化物HF分子间存在氢键,缔合成(HF)n,故测定HF的相对分子质量结果总比理论值高,
故答案为:HF分子间存在氢键,缔合成(HF)n;
(4)晶胞中O原子数目=12×
=3、Ti原子数目=8×
=1、Ca原子数目=1,则化学式为CaTiO3;由晶胞结构可知,由Ca原子周围与之最近的为O原子,位于晶胞棱中间,共有12个,故Ca的配位数为12;晶胞的质量=
g=
g,晶胞的体积=a3cm3,则晶胞的密度=
=
g/cm3,
故答案为:CaTiO3;12;
.
(1)Cr原子核外电子数为24,由洪特规则特例可知,其价电子排布式为3d54s1;M2+离子3d轨道中有6个电子,则M原子价电子排布式为3d64s2,为Fe元素,处于第四周期第Ⅷ族;
故答案为:3d54s1;四、Ⅷ;
(2)相同条件下与水反应,钾比钠剧烈(或最高价氧化物对应的水化物的碱性:KOH>NaOH),可以说明金属性K比Na强,根据原子结构,虽然钾的核电荷数比钠多,但钾的半径比钠大,核对最外层电子的引力钾比钠小,故钾易失去电子,金属性强,
故答案为:相同条件下与水反应,钾比钠剧烈(或最高价氧化物对应的水化物的碱性:KOH>NaOH);虽然钾的核电荷数比钠多,但钾的半径比钠大,核对最外层电子的引力钾比钠小,故钾易失去电子,金属性强;
(3)B的气态氢化物HF分子间存在氢键,缔合成(HF)n,故测定HF的相对分子质量结果总比理论值高,
故答案为:HF分子间存在氢键,缔合成(HF)n;
(4)晶胞中O原子数目=12×
| 1 |
| 4 |
| 1 |
| 8 |
| 40+48×16×3 |
| NA |
| 136 |
| NA |
| ||
| a3cm3 |
| 136 |
| NAa3 |
故答案为:CaTiO3;12;
| 136 |
| NAa3 |
点评:本题考查元素周期表结构、核外电子排布、元素周期律、氢键、晶胞结构与计算等,难度中等,注意掌握均摊法进行晶胞的计算.

练习册系列答案
相关题目
(13分)下表为周期表的一部分,表中所列的字母分别代表一种化学元素。
|
a |
|
|
|
|
|||||||||||||
|
|
|
|
|
b |
c |
d |
|
|
|||||||||
|
|
|
|
|
|
e |
f |
|
|
|||||||||
|
|
|
|
|
|
g |
|
h |
|
|
|
|
|
|
|
|
|
|
用化学用语回答下列问题:
(1)写出元素g的基态原子核外电子排布式___________________________,
h2+中未成对电子数为 。
(2)在b2a2分子中,元素b为 杂化,该分子是 分子(填“极性”或“非极性”),该分子中σ键和π键的数目比为 。
(3) bd2与bf2比较,沸点较高的是_______(填分子式),原因是 。
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙正确是 。
A.h位于元素周期表中第四周期第VIII族,属于d区元素
B.e的基态原子中,3p能级为半充满,属于p区元素
C.最外层电子排布式为4s2,一定属于IIA族
D.最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族
(5)科学研究表明,元素b与元素c可以形成一种超硬、耐磨、耐高温的新型无机非金属材料,其化学式为 ,其熔点比金刚石 (填“高”或“低”)。


 其价电子排布式__________。第四周期中电子排布4s轨道上电子数与之相同的还有 元素(填元素符号)。
其价电子排布式__________。第四周期中电子排布4s轨道上电子数与之相同的还有 元素(填元素符号)。