题目内容
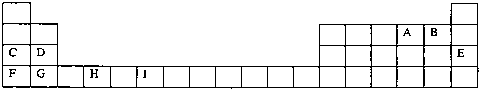
(13分)下表为周期表的一部分,表中所列的字母分别代表一种化学元素。
|
a |
|
|
|
|
|||||||||||||
|
|
|
|
|
b |
c |
d |
|
|
|||||||||
|
|
|
|
|
|
e |
f |
|
|
|||||||||
|
|
|
|
|
|
g |
|
h |
|
|
|
|
|
|
|
|
|
|
用化学用语回答下列问题:
(1)写出元素g的基态原子核外电子排布式___________________________,
h2+中未成对电子数为 。
(2)在b2a2分子中,元素b为 杂化,该分子是 分子(填“极性”或“非极性”),该分子中σ键和π键的数目比为 。
(3) bd2与bf2比较,沸点较高的是_______(填分子式),原因是 。
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙正确是 。
A.h位于元素周期表中第四周期第VIII族,属于d区元素
B.e的基态原子中,3p能级为半充满,属于p区元素
C.最外层电子排布式为4s2,一定属于IIA族
D.最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族
(5)科学研究表明,元素b与元素c可以形成一种超硬、耐磨、耐高温的新型无机非金属材料,其化学式为 ,其熔点比金刚石 (填“高”或“低”)。
(1)1s22s22p63s23p63d54s1 (2分) 4(1分)
(2)sp (1分) 非极性(1分) 3:2(1分)
(3)CS2 (1分) 相对分子质量大,分子间作用力(范德华力)大(2分)
(4)AB (2分) (5)C3N4 (1分) 高(1分)
【解析】(1)根据元素在周期表中的位置可知,g是铬元素,原子序数为24,由于半充满或全充满稳定性强,所以根据构造原理可知,基态原子核外电子排布式1s22s22p63s23p63d54s1。H是铁元素,亚铁离子中含有的未成对电子数为4。
(2)b2a2分子是乙炔,属于直线型结构,键角是180°的,是非极性分子,碳原子是sp杂化。单键都是σ键,三键是有1个σ键和2个π键形成的,所以分子中σ键和π键的数目比为3:2。
(3)bd2与bf2分别是CO2和CS2,形成的晶体都是分子晶体,沸点高低与分子间作用力大小有关系。相对分子质量越大,分子间作用力越强,沸点越高,所以CS2的沸点高。
(4)最外层电子排布式为4s2,也可能是过渡元素,例如铁等,C不正确。最外层电子排布式为ns2np1的一定是第ⅢA族,D不正确。AB是正确的,答案选AB。
(5)b和c分别是C和N,氮的非金属性强于C的,所以N元素显负价,碳元素显正价,分别为-3价和+4价,因此化学式为C3N4。由于该化合物具有超硬、耐磨、耐高温,所以是原子晶体,由于氮原子的原子半径小于碳原子的,所以晶体中共价键强于金刚石中的共价键,即熔点高于金刚石的。



 其价电子排布式__________。第四周期中电子排布4s轨道上电子数与之相同的还有 元素(填元素符号)。
其价电子排布式__________。第四周期中电子排布4s轨道上电子数与之相同的还有 元素(填元素符号)。