题目内容
9.向100mL2mol/L的AlCl3溶液中加入1mol/L的KOH溶液,生成沉淀的质量为7.8g,加入溶液的体积可能为①100mL②300mL③700mL④800mL⑤1000mL( )| A. | ①或② | B. | ②或④ | C. | ②或③ | D. | ②或⑤ |
分析 100mL 2mol/L的AlCl3溶液中氯化铝的物质的量=0.1L×2mol/L=0.2mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.2mol×78g/mol=15.6g>7.8g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,结合方程式计算消耗氢氧化钠物质的量,进而计算需要氢氧化钠溶液体积.
解答 解:100mL 2mol/L的AlCl3溶液中氯化铝的物质的量=0.1L×2mol/L=0.2mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.2mol×78g/mol=15.6g>7.8g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2.
n(Al(OH)3)=$\frac{7.8g}{78g/mol}$=0.1mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,
NaOH的物质的量为0.1mol×3=0.3mol,
加入NaOH溶液的体积为$\frac{0.3mol}{1mol/L}$=0.3L=300mL;
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3OH-═Al(OH)3↓
0.2mol 0.6mol 0.2mol
溶解的氢氧化铝为0.2mol-0.1mol=0.1mol,则:
Al(OH)3+OH-═AlO2-+2H2O
0.1mol 0.1mol
则消耗的碱的物质的量为0.6mol+0.1mol=0.7mol,
加入NaOH溶液的体积为$\frac{0.7mol}{1mol/L}$=0.07L=700mL;
故选:C.
点评 本题考查方程式的有关计算,题目难度中等,关键是根据氯化铝与氢氧化铝的量判断发生的反应,再结合反应的有关方程式计算.

| A. | 在任何条件下,纯水都呈中性 | |
| B. | 电离平衡常数Ka越小,表示弱电解质电离能力越强 | |
| C. | 为保存FeCl3溶液,要在溶液中加少量硫酸 | |
| D. | 明矾溶液蒸干得到的固体为Al(OH)3 |
| A. | 在标准状况下,1mol任何物质的体积为22.4L | |
| B. | 等物质的量的HCl和 H 2 SO4中,H+的物质的量也相等 | |
| C. | 1molH 2和1molHe中,所含的分子数相同、原子数相同、质量也相同 | |
| D. | 体积为6L的 O 2,其质量可能为8g |
| 选项 | 甲 | 乙 | ||
| 滴管中 | 烧瓶中 | 滴管中 | 烧瓶中 | |
| A | 水 | 钠 | 饱和碳酸钠溶液 | CO2 |
| B | 水 | 过氧化钠 | 饱和碳酸氢钠溶液 | CO2 |
| C | NaOH溶液 | 碳酸氢钠 | 澄清石灰水 | 碳酸氢钠 |
| D | 稀盐酸 | 碳酸氢钠 | FeCl3溶液 | Cu |
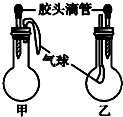
| A. | A | B. | B | C. | C | D. | D |
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性 |
| B | 将盐酸缓缓滴入Na2CO3溶液中 | 有气泡产生 | 二者不反应 |
| C | 向某溶液中加入浓NaOH溶液并加热,在试管口用湿润红色石蕊纸检验 | 试纸变蓝 | 原溶液中含有NH4+ |
| D | 向氢氧化铁胶体中滴加氯化铵饱和溶液 | 产生沉淀 | 沉淀为FeCl3 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
| A. | 工业炼铁 | B. | 实验室制取二氧化碳 | ||
| C. | 用汽油除去衣服上的油渍 | D. | 用少量食醋除去水壶中的水垢 |
| A. | 新制氯水中只含Cl2和H2O | |
| B. | 将镁粉加入新制氯水中无明显变化 | |
| C. | 氯水放置一段时间后颜色将变深 | |
| D. | 新制氯水可使紫色石蕊试液先变红后褪色 |
| A. | 明矾在水中生成的Al(OH)3胶体有吸附性,因此常用明矾对水进行消毒 | |
| B. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧产生的 | |
| C. | 氨气很容易液化,液氨汽化吸收大量的热,所以液氨常用作制冷剂 | |
| D. | 为了消除碘缺乏病,在食用盐中加入一定量的碘单质 |