题目内容
11.设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )| A. | 20 g D2O含有的中子数为8NA | |
| B. | 25℃时,l L pH=2的H2SO3溶液中所含H+数为0.01 NA | |
| C. | 标准状况下,22.4 L CH3OH中含有的共价键数为5 NA | |
| D. | 0.1 mol Cl2溶于水,转移电子数目为0.1 NA |
分析 A、求出重水的物质的量,然后根据重水中含10个中子来分析;
B、25℃时,pH=2的亚硫酸溶液中,氢离子浓度为0.01mol/L;
C、标况下甲醇为液体;
D、氯气和水的反应为可逆反应.
解答 解:A、20g重水的物质的量为1mol,而重水中含10个中子,故1mol重水中含10NA个中子,故A错误;
B、25℃时,pH=2的亚硫酸溶液中,氢离子浓度为0.01mol/L,故1L此溶液中含有的氢离子的物质的量为0.01mol,个数为0.01NA个,故B正确;
C、标况下甲醇为液体,故不能根据气体摩尔体积来计算其物质的量和共价键数,故C错误;
D、氯气和水的反应为可逆反应,不能进行彻底,故转移的电子数目小于0.1NA,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意公式的运用和物质的结构特点.

练习册系列答案
相关题目
19.关于a:0.1mol/L NH4Cl溶液和b:0.1mol/L NH3•H2O溶液,下列说法不正确的是( )
| A. | 两溶液中存在的微粒种类:a>b | B. | c(NH4+):a>b | ||
| C. | c(OH-):a<b | D. | 水电离出的c(H+):a<b |
6.未来可再生能源和清洁能源将成为人类利用新能源的主力军,下列关于能源的叙述正确的是( )
| A. | 化石燃料是可再生能源 | B. | 风能、太阳能是清洁能源 | ||
| C. | 化石燃料都是清洁能源 | D. | 氢能是不可再生的清洁能源 |
16.一种微生物燃料电池如图所示,下列关于该电池说法正确的是( )
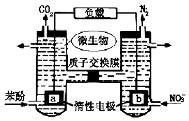

| A. | a电极为正极 | |
| B. | H+由右室通过质子交换膜进入左室 | |
| C. | a电极反应式为:C6H5OH-28e-+11H2O═6CO2↑+28H+ | |
| D. | 当b电极上产生lmol N2时,溶液中将有l0mol e-通过 |
3.下列实验操作对应的实验现象及解释或结论都正确的是( )
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 用某无色溶液进行焰色反应 | 火焰呈黄色 | 原溶液一定是钠盐溶液 |
| B | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈红色 | 稀硝酸将Fe氧化为Fe3+ |
| C | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:氧化铝>铝 |
| D | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应:N2O4(g)?2NO2(g)△H<0 |
| A. | A | B. | B | C. | C | D. | D |
20.化学在生活中有着广泛的应用,下列对应关系错误的是( )
| 化学性质 | 实际应用 | |
| A | 小苏打受热易分解 | 焙制糕点 |
| B | 蛋白质受热变性 | 高温杀死流感病毒 |
| C | SO2具有漂白性 | 漂白滋补品银耳等食品 |
| D | Al(OH)3分解吸收大量热量并有水生成 | 阻燃剂 |
| A. | A | B. | B | C. | C | D. | D |
20.氮氧化物与悬浮在大气中的食盐粒子相互反应:
4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)在恒温条件下,向2L恒容密闭容器中加入0.4molNO2和0.2molNaCl,10min反应达到平衡时n(NaNO3)=0.1mol.下列叙述中正确的是( )
4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)在恒温条件下,向2L恒容密闭容器中加入0.4molNO2和0.2molNaCl,10min反应达到平衡时n(NaNO3)=0.1mol.下列叙述中正确的是( )
| A. | 10min内NaCl浓度变化表示的速率v(NaCl)=0.005 mol•L-1•min-1 | |
| B. | 若保持其他条件不变,在恒压下进行该反应,则平衡时NO2的转化率大于50% | |
| C. | 若升高温度,平衡逆向移动,则该反应的△H>0 | |
| D. | 若起始时向容器中充入0.2molNO2(g)、0.1molNO(g)和0.1molCl2(g)(固体物质足量),则反应将向正反应方向进行 |