题目内容
(1)0.5mol H2SO4 的质量是 g,含 个氧原子,能和 molNaOH完全反应,该硫酸所含氢元素的质量与 mol H3PO4或标准状况下 L HCl中所含氢元素的质量相同.
(2)某真空密闭容器的质量为50g,当装满CO2气体时,质量为58.8g,如果装满CH4气体时,此密闭容器的质量为 .
(3)已知某气体氧化物的分子式为R2O3,在标准状况下,7.6g该气体的体积是2240mL,则此氧化物的摩尔质量是 ,R的相对原子质量是 .
(4)等物质的量的Na、Mg、Al分别于足量盐酸反应,产生H2的质量之比为 .
(2)某真空密闭容器的质量为50g,当装满CO2气体时,质量为58.8g,如果装满CH4气体时,此密闭容器的质量为
(3)已知某气体氧化物的分子式为R2O3,在标准状况下,7.6g该气体的体积是2240mL,则此氧化物的摩尔质量是
(4)等物质的量的Na、Mg、Al分别于足量盐酸反应,产生H2的质量之比为
考点:物质的量的相关计算
专题:计算题
分析:(1)利用m=n×M来计算质量,利用构成来计算原子数,利用H++OH-═H2O来计算需要的NaOH的物质的量,再根据3H2SO4~2H3PO4~6HCl来计算;
(2)因容器的体积相同,则气体的物质的量相等,利用n=
来计算;
(3)利用n=
,M=
来计算摩尔质量,摩尔质量与相对分子质量的数值相等,单位不同;
(4)根据关系式进行计算.
(2)因容器的体积相同,则气体的物质的量相等,利用n=
| m |
| M |
(3)利用n=
| V |
| Vm |
| m |
| n |
(4)根据关系式进行计算.
解答:
解:(1)H2SO4的质量为0.5mol×98g/mol=49g,
氧原子数为0.5mol×4×6.02×1023=1.204×1024,
又H++OH-═H2O,则需要的NaOH的物质的量为0.5mol×2=1mol,
设磷酸和HCl的物质的量分别为x、y,
由3H2SO4~2H3PO4~6HCl,则
3 2 6
0.5mol x y,
=
,
=
,解得x=
mol,y=1mol,
标准状况下HCl的体积为1mol×22.4L/mol=22.4L,
故答案为:49;1.204×1024;1;
或0.333;22.4;
(2)气体的物质的量为
=0.2mol,
则装满甲烷时甲烷的质量为0.2mol×16g/mol=3.2g,
即装满CH4气体时,此密闭容器的质量50g+3.2g=53.2g,
故答案为:53.2g;
(3)气体的物质的量为
=0.1mol,
摩尔质量为
=76 g.mol-1,
则氧化物的相对分子质量为76,设R的原子量为z,
2×z+16×3=76,解得z=14,
故答案为:76 g.mol-1;14;
(4)因等物质的量的Na、Mg、Al与足量的盐酸反应生成的H2,由关系式:2Na~H2,2Mg~2H2,2Al~3H2,产生H2的质量之比为:1:2:3,
故答案为:1:2:3.
氧原子数为0.5mol×4×6.02×1023=1.204×1024,
又H++OH-═H2O,则需要的NaOH的物质的量为0.5mol×2=1mol,
设磷酸和HCl的物质的量分别为x、y,
由3H2SO4~2H3PO4~6HCl,则
3 2 6
0.5mol x y,
| 3 |
| 2 |
| 0.5mol |
| x |
| 3 |
| 6 |
| 0.5mol |
| y |
| 1 |
| 3 |
标准状况下HCl的体积为1mol×22.4L/mol=22.4L,
故答案为:49;1.204×1024;1;
| 1 |
| 3 |
(2)气体的物质的量为
| 58.8g-50g |
| 44g/mol |
则装满甲烷时甲烷的质量为0.2mol×16g/mol=3.2g,
即装满CH4气体时,此密闭容器的质量50g+3.2g=53.2g,
故答案为:53.2g;
(3)气体的物质的量为
| 2.24L |
| 22.4l/mol |
摩尔质量为
| 7.6g |
| 0.1mol |
则氧化物的相对分子质量为76,设R的原子量为z,
2×z+16×3=76,解得z=14,
故答案为:76 g.mol-1;14;
(4)因等物质的量的Na、Mg、Al与足量的盐酸反应生成的H2,由关系式:2Na~H2,2Mg~2H2,2Al~3H2,产生H2的质量之比为:1:2:3,
故答案为:1:2:3.
点评:本题考查以物质的量为中心的计算,明确物质的量、质量、体积、摩尔质量及微观粒子数的关系即可解答,(2)是学生解答中的难点.

练习册系列答案
相关题目
在2H2S+SO2═3S+2H2O的反应中当有4×6.02×1023个电子发生转移,得到氧化产物和还原产物的和为( )
| A、2mol | B、3mol |
| C、64g | D、32g |
浓度为2mol/L的NaOH溶液的正确含义是( )
| A、在2L水中溶有80g的NaOH |
| B、80gNaOH溶于水配成的溶液 |
| C、每升溶液中含有80gNaOH |
| D、每2L溶液中含有80gNaOH |
“纳米技术”广泛地应用于催化及军事科学中,“纳米材料”是指粒子直径在几纳米到几十纳米(nm)之间的材料(1nm=10-9m).如将纳米材料分散到液体分散剂中,所得混合物具有的性质是( )
| A、能全部透过半透膜 |
| B、用激光笔照射有光亮的“通路” |
| C、所得溶液一定能导电 |
| D、所得物质一定为悬浊液或乳浊液 |
据中央电视台报道,近年来我国的一些沿江城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾中小水滴的直径范围是( )
| A、小于1nm |
| B、1-100nm |
| C、大于100nm |
| D、无法确定 |
有机物X、Y分子式不同,它们只含C、H、O元素中的两种或三种,若将X、Y不论何种比例混合,只要其物质的量之和不变,完全燃烧时耗氧气量也不变.X、Y可能是( )
| A、CH4、C2H4O2 |
| B、C2H2、C6H6 |
| C、CH2O、C3H6O2 |
| D、C2H4、C2H6 |
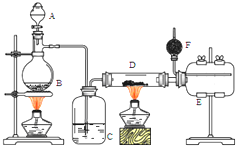 无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾.实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al+6HCl(g)═2AlCl3+3H2.完成下列填空:
无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾.实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al+6HCl(g)═2AlCl3+3H2.完成下列填空: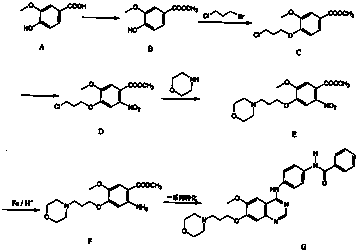
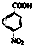 )为原料合成对氨基苯甲酸乙酯(
)为原料合成对氨基苯甲酸乙酯(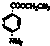 )的合成路线(试剂任选,用合成路线流程图表示)
)的合成路线(试剂任选,用合成路线流程图表示)