题目内容
 水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.(1)在酸性溶液中,水分子容易得到一个H+,形成水合氢离子(H3O+).对于这一过程,下列描述不合理的是
A.氧原子的杂化类型发生了改变B.微粒的形状发生了改变
C.微粒的化学性质发生了改变D.微粒中的键角发生了改变
根据价层电子对互斥理论推测H3O+的形状为
(2)水分子和硫化氢分子的键角及中心原子的杂化方式如下表:
| 分子 | H2O | H2S |
| 中心原子杂化方式 | sp3 | |
| 键角 | 104.5° | 92.1° |
| 键长 | 95.7pm | 133.6pm |
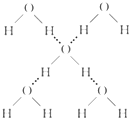
(3)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51kJ/mol,除氢键外,水分子间还存在范德华力(11kJ/mol),则冰晶体中氢键的“键能”是
考点:原子轨道杂化方式及杂化类型判断,键能、键长、键角及其应用
专题:化学键与晶体结构
分析:(1)H2O、H3O+中O原子都采用sp3杂化,但H2O、H3O+的空间构型分别是V形和三角锥形;
(2)共价键键长越短,键能越大;O的电负性大于S,O与H的两对成键电子更靠近中心原子,排斥力大,键角大;
(3)升华热=范德华力+氢键,利用均摊法计算水分子与氢键的关系,结合升华热、范德华力计算氢键键能.
(2)共价键键长越短,键能越大;O的电负性大于S,O与H的两对成键电子更靠近中心原子,排斥力大,键角大;
(3)升华热=范德华力+氢键,利用均摊法计算水分子与氢键的关系,结合升华热、范德华力计算氢键键能.
解答:
解:(1)A、水中氧的杂化为sp3,H3O+中氧的杂化为sp3,则氧原子的杂化类型没有改变,故A不合理;
B、水分子为V型,H3O+为三角锥型,则微粒的形状发生了改变,故B合理;
C、因结构不同,则性质不同,微粒的化学性质发生了改变,故C合理;
D、水分子为V型,H3O+为三角锥型,微粒中的键角发生了改变,故D合理;
根据价层电子对互斥理论,H3O+中氧的杂化为sp3,VSEPR模型为四面体形,含有1个孤电子对,H3O+的形状为三角锥形,
故答案为:A;三角锥形;
(2)共价键键长越短,键能越大;O的电负性大于S,O与H之间的两对成键电子比S与H之间的两对成键电子更靠近中心原子,因此O与H之间的两对成键电子距离近,排斥力大,键角大,
故答案为:>;O的电负性大于S,O与H之间的两对成键电子比S与H之间的两对成键电子更靠近中心原子,因此O与H之间的两对成键电子距离近,排斥力大,键角大;
(3)冰的升华热是51kJ/mol,水分子间还存在范德华力(11kJ/mol),根据图象知,1mol水中含有2mol氢键,升华热=范德华力+氢键,所以冰晶体中氢键的“键能”是20kJ/mol,
故答案为:20.
B、水分子为V型,H3O+为三角锥型,则微粒的形状发生了改变,故B合理;
C、因结构不同,则性质不同,微粒的化学性质发生了改变,故C合理;
D、水分子为V型,H3O+为三角锥型,微粒中的键角发生了改变,故D合理;
根据价层电子对互斥理论,H3O+中氧的杂化为sp3,VSEPR模型为四面体形,含有1个孤电子对,H3O+的形状为三角锥形,
故答案为:A;三角锥形;
(2)共价键键长越短,键能越大;O的电负性大于S,O与H之间的两对成键电子比S与H之间的两对成键电子更靠近中心原子,因此O与H之间的两对成键电子距离近,排斥力大,键角大,
故答案为:>;O的电负性大于S,O与H之间的两对成键电子比S与H之间的两对成键电子更靠近中心原子,因此O与H之间的两对成键电子距离近,排斥力大,键角大;
(3)冰的升华热是51kJ/mol,水分子间还存在范德华力(11kJ/mol),根据图象知,1mol水中含有2mol氢键,升华热=范德华力+氢键,所以冰晶体中氢键的“键能”是20kJ/mol,
故答案为:20.
点评:本题考查了晶胞的计算、杂化理论等知识点,难点是计算氢键的键能,会运用均摊法计算晶胞是解本题的关键,题目难度较大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
下列实验过程中产生的现象与对应的图形正确的是( )
A、 盐酸中加入Na[Al(OH)4]溶液 |
B、 SO2气体通入溴水中 |
C、 向Na2CO3溶液中逐滴滴加盐酸 |
D、 氨水通入醋酸溶液中 |

 某稀硫酸和硝酸的混合溶液200mL,分成两份.向其中一份逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO).向另一份逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如图所示.
某稀硫酸和硝酸的混合溶液200mL,分成两份.向其中一份逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO).向另一份逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如图所示. (1)人们在对烷烃分子空间结构的研究中发现某一系列的烷烃分子只有一种一卤代物.如:
(1)人们在对烷烃分子空间结构的研究中发现某一系列的烷烃分子只有一种一卤代物.如: