题目内容
11.短周期主族元素X、Y、Z、W的原子序数依次增大,已知X、Z的原子序数之差为8,X、Y、Z三种元素原子的最外层电子数之和为15,Y元素原子的最外层电子数等于X元素原子的最外等电子数的一半,下列叙述正确的是( )| A. | 简单离子的半径:Y>X | |
| B. | 氢化物的稳定性:Z>W | |
| C. | X与Z形成的化合物溶于水所得溶液显碱性 | |
| D. | Y与W形成的化合物溶于水所得溶液显酸性 |
分析 短周期主族元素X、Y、Z、W的原子序数依次增大,Y元素原子的最外层电子数等于X元素原子的最外层电子数的一半,X处于偶数族,X、Z的原子序数之差为8,二者只能同主族,令Y的最外层电子数为x,则X、Z原子最外层电子数为2x,三种元素原子的最外层电子数之和为15,则x+2x+2x=15,解得x=3,则X为O元素,Y为Al元素,Z为S元素,W为Cl元素,据此解答.
解答 解:短周期主族元素X、Y、Z、W的原子序数依次增大,Y元素原子的最外层电子数等于X元素原子的最外层电子数的一半,X处于偶数族,X、Z的原子序数之差为8,二者只能同主族,令Y的最外层电子数为x,则X、Z原子最外层电子数为2x,三种元素原子的最外层电子数之和为15,则x+2x+2x=15,解得x=3,则X为O元素,Y为Al元素,Z为S元素,W为Cl元素.
A.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Al3+,故A错误;
B.非金属性Z(S)<W(Cl),故氢化物稳定性Z<W,故B错误;
C.X与Z形成的化合物为二氧化硫、三氧化硫,溶于水形成亚硫酸、硫酸,它们的溶于呈酸性,故C错误;
D.Y与W形成的化合物为氯化铝,溶于中铝离子水解,溶液呈酸性,故D正确.
故选:D.
点评 本题考查结构性质位置关系综合应用,侧重对元素周期律的考查,关键是计算确定元素种类,较好的考查学生分析推理能力以及元素化合物知识.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
9.下列说法中不正确的是( )
| A. | 能发生脂化反应的酸一定是羧酸 | |
| B. | 蛋白质溶液中加入浓Na2SO4溶液,蛋白质从溶液中凝聚而析出叫盐析 | |
| C. | 天然蛋白质一定条件下水解的最终产物是α-氨基酸 | |
| D. | 淀粉、纤维素和油脂在一定条件下都能发生水解反应 |
3.短周期元素X、Y、Z三种原子原子序数之和为25,且Z、Y原子序数之和是X的原子序数2倍还多1.已知它们可形成化合物Y2X和ZX2,Y2X溶于水可与ZX2反应生成一种化合物Y2ZX3,下列有关分析不正确的是( )
| A. | X、Y、Z在周期表中不可能处于同一周期 | |
| B. | 原子序数Y>X>Z | |
| C. | 简单离子半径:r(X2-)>r(Y+) | |
| D. | Y 单质在X单质中点燃生成物离子个数之比为1:1 |
20.Q、W、X、Y、Z五种短周期元素在元素周期表中的相对位置如图所示,其中W的单质是一种重要半导体材料.
请按要求回答下列问题:
(1)Y的原子结构示意图为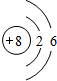 ;举一例说明Z的非金属性比X的非金属性强的事实:酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3.
;举一例说明Z的非金属性比X的非金属性强的事实:酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3.
(2)W、X、Y的原子半径由大到小依次是(填元素符号)r(Si)>r(P)>r(O);W与Z形成的化合物电子式为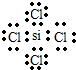 .
.
(3)将Z的单质通入到含等物质的量FeBr2溶液中充分反应的离子方程式为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-.
(4)已知:2Na(s)+1/2Y2(g)=Na2Y(s)△H=-414kJ/mol;2Na(s)+Y2(g)═Na2Y2(s)△H=-511kJ/mol;则Na2Y(s) 转变为Na2Y2(s)的反应一定条件下能自发进行的理由是Na2O(s)+$\frac{1}{2}$O2(g)=Na2O2(s)△H=-97 kJ/mol,而△S<0,△H-T△S在低温下小于0,可自发进行.
将0.2mol Na2Y2加入到100mL1mol/L QZ3中,充分反应的化学方程式为2Na2O2+AlCl3=NaAlO2+3NaCl+O2↑.
(5)R与W同周期,已知:在T℃时Ksp[R(OH)2]的值为4.0×l0-12,则R(OH)2饱和溶液中c(OH-)=2.0×l0-4 mol•L-1.
| Y | ||||
| Q | W | X | Z |
(1)Y的原子结构示意图为
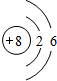 ;举一例说明Z的非金属性比X的非金属性强的事实:酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3.
;举一例说明Z的非金属性比X的非金属性强的事实:酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3.(2)W、X、Y的原子半径由大到小依次是(填元素符号)r(Si)>r(P)>r(O);W与Z形成的化合物电子式为
 .
.(3)将Z的单质通入到含等物质的量FeBr2溶液中充分反应的离子方程式为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-.
(4)已知:2Na(s)+1/2Y2(g)=Na2Y(s)△H=-414kJ/mol;2Na(s)+Y2(g)═Na2Y2(s)△H=-511kJ/mol;则Na2Y(s) 转变为Na2Y2(s)的反应一定条件下能自发进行的理由是Na2O(s)+$\frac{1}{2}$O2(g)=Na2O2(s)△H=-97 kJ/mol,而△S<0,△H-T△S在低温下小于0,可自发进行.
将0.2mol Na2Y2加入到100mL1mol/L QZ3中,充分反应的化学方程式为2Na2O2+AlCl3=NaAlO2+3NaCl+O2↑.
(5)R与W同周期,已知:在T℃时Ksp[R(OH)2]的值为4.0×l0-12,则R(OH)2饱和溶液中c(OH-)=2.0×l0-4 mol•L-1.
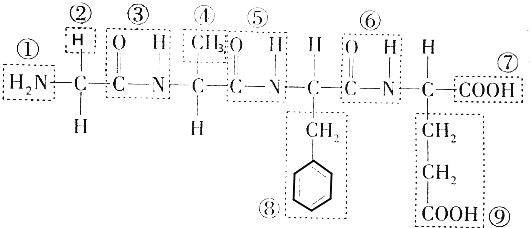

 ;由B→C的反应类型是:取代反应.
;由B→C的反应类型是:取代反应. .
. .
. .
. ,请写出以
,请写出以 为原料制备化合物X
为原料制备化合物X  (结构简式见图)的合成路线流程图(无机试剂可任选):
(结构简式见图)的合成路线流程图(无机试剂可任选): .
.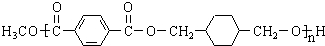 ,某研究小组用芳香烃A为原料合成PCT的合成路线如下.
,某研究小组用芳香烃A为原料合成PCT的合成路线如下.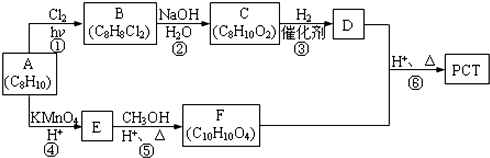
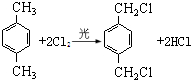 ,A分子中最多有14个原子共平面.
,A分子中最多有14个原子共平面.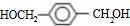 ,反应③的类型是加成反应,
,反应③的类型是加成反应,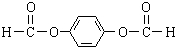 (写结构简式).
(写结构简式).